Introduction
Eté 2018, Bordeaux, Toulouse, Lyon, Saint-Etienne, Nantes, Angers, Lorient, Reims, Troyes, Monaco, des villes dont le point commun est le nom d’un champignon pathogène ravageant leur pelouse de stade de Ligue 1 ou 2. Son nom : Pyricularia Oryzae, ou pyriculariose ou encore Gray Leaf Spot. Ce champignon historiquement ravageur de la culture du riz s’est peu à peu répandu sur les graminées fourragères dans les années 70 puis sur plusieurs espèces de gazon dans les années 90 aux USA. Contrairement aux idées reçues, ce champignon n’est pas du tout nouveau et les solutions existent déjà outre-mer avec bientôt 30 ans de recul. Durant l’été 2018, nombreux sont les articles de journaux ou commentaires sur les sur les pelouses françaises des plus gros clubs1,2.
Différents articles tentent d’ailleurs d’apporter plus d’explications sur les origines de cette problématique3–5 mais rien n’est très précis ni documenté. A l’aide de nombreuses références scientifiques issues des travaux scientifiques à travers le monde, cet article a d’abord pour but, d’apporter plus de clarté et d’explications précises sur le phénomène. Il évoque dans une seconde partie les solutions potentielles et pratiques à mettre en œuvre pour les intendants des pelouses sportives. Enfin, l’article se termine par les réponses aux questions posées par la clinique du gazon à deux scientifiques experts du champignon pathogène : P. Landschoot et B. Clarke des université de Penn State et de Rutgers. Merci pour leur aimable participation.
Auteur : R. GIRAUD
Identification du champignon
La maladie du raygrass anglais Gray Leaf Spot est causé par Magnaporthe oryzae6 (M. oryzae) dont la forme anamorphe (forme reproductrice asexuée) est Pyricularia oryzae7 anciennement désignée Pyricularia grisea8 (P. Grisea). Couch et Kohn avaient en effet proposé en 2002 de diviser Magnaporthe grisea en deux espèces : M. Grisea et M. Oryzae suivant les différentes souches causant des maladies sur de nombreuses graminées incluant le raygrass anglais6. Seule la forme anamorphe est rencontrée dans la nature même si la forme téléomorphe (forme sexuée) a été obtenue in-vitro9. Dans cet article sera utilisé le terme P. Oryzae.
Magnaporthe oryzae est un champignon ascomycète de la famille des Magnaporthaceae. Il est pathogène sur plus de 50 graminées10 incluant les céréales, les graminées fourragères mais également les gazons8,11–14. Ce pathogène est probablement le plus connu sur la culture du riz (Oryza sativa L.) dont il provient probablement avec des dégâts parfois dévastateurs et spectaculaires sur une distribution géographique large15. Il est en effet capable d’infecter le riz à n’importe quel stade de croissance causant une mort rapide du plant d’où l’appellation « blast » par les anglosaxons. Ce terme est d’ailleurs repris lorsque le champignon se développe sur éleusine (Eleusine Corocana) et sur blé (Triticum aestivum L.). Les principales autres plantes hôtes touchées par le champignon sont le blé, l’orge, Setaria spp., Eleusine spp., Leersia spp. et Panicum spp.15.

Origine et diversité génétique
La compréhension de la génétique du champignon et de son mode de reproduction est un facteur clé dans la gestion des épidémies (efficacité des fongicides, sélection de cultivars résistants, viabilité des souches dans le temps). Une variabilité génétique élevée implique évidemment une plus grande habileté pour le champignon à trouver des parades lors des recombinaisons génétiques (reproduction sexuée) pour devenir résistant à des familles de fongicides ou virulents sur des cultivars résistants16. La reproduction sexuée en ce sens est connue pour être la source la plus importante de variabilité génétique pour les champignons puisque les individus partagent alors leur ressource génétique. La reproduction asexuée quant à elle, implique une reproduction dite « clonale » qui transmet le même patrimoine génétique d’un individu à l’autre et donc des caractéristiques identiques sauf dans le cas de mutations.
Très peu d’évidences scientifiques sont connues à propos de l’origine et la propagation des populations de P. Oryzae associées aux espèces de gazon comparées à celles du riz ou mauvaises herbes de cette culture dont le champignon pathogène provient16. Couch émet l’hypothèse en 2005 d’un déplacement des souches du champignon depuis les sétaires jusqu’au riz lors de la domestication de la graminée9. P. Oryzae se serait ensuite étendu à d’autres plantes hôtes indésirables sur la culture du riz (Panicum, Leersia)9 mais le lien reste incertain. Le même chercheur pense que les lignées de P. Oryzae se seraient adaptées aux plantes hôtes citées précédemment et auraient divergé avec une faible diversité génétique que l’on peut imaginer comme un arbre à branches9,15. Deux études plus récentes vont dans le sens de cette hypothèse17,15. Selon la première17, la diversité génétique des souches isolées sur riz en Asie est 3 à 4 fois supérieure à la diversité observée en Europe ou en Amérique. Toutes les infections observées ailleurs dans le monde seraient secondaires et auraient une origine asiatique. La reproduction par voie clonale dans les autres régions du globe explique une diversité génétique plus faible. En Europe et dans le bassin méditerranéen, toutes les populations proviennent d’un même groupe (voir figure 2). L’auteur pense ainsi que l’épidémie européenne proviendrait d’une source inconnue qui s’est dispersée. L’autre publication15 de 2015 étudie la diversité génétique de P. Oryzae sur différentes plantes hôtes pour étudier les liens entre les populations. Il en résulte encore une divergence des lignées des plantes hôtes sans grande diversité génétique, allant bien dans le sens d’une origine probable en Asie. Malheureusement, très peu de données existent sur les souches isolées en Europe sur les espèces de gazon et il est difficile de trouver l’origine exacte des souches.
Bien que les populations de P. Oryzae se reproduisent par voie clonale à une échelle locale (chaque individu transporte le même bagage génétique sauf dans le cas de mutations) des traces d’anciennes recombinaisons génétiques existent9. Des évidences de reproductions sexuées pourtant non observées dans la nature ont d’ailleurs été relevées dans certaines régions de l’Asie du Sud-Est, non loin du berceau de la maladie17–19. Il semblerait par contre que les migrations vers les autres continents (Europe, USA) aient été accompagnées par une perte systématique de la reproduction sexuée et donc une reproduction uniquement clonale. Enfin, malgré cette reproduction clonale, l’étude de la diversité génétique des populations de P. Oryzae isolées sur riz à travers le temps montre l’augmentation de la diversité au bout de 10 ans en Californie20. Certains mécanismes ne sont donc pas encore bien connus.
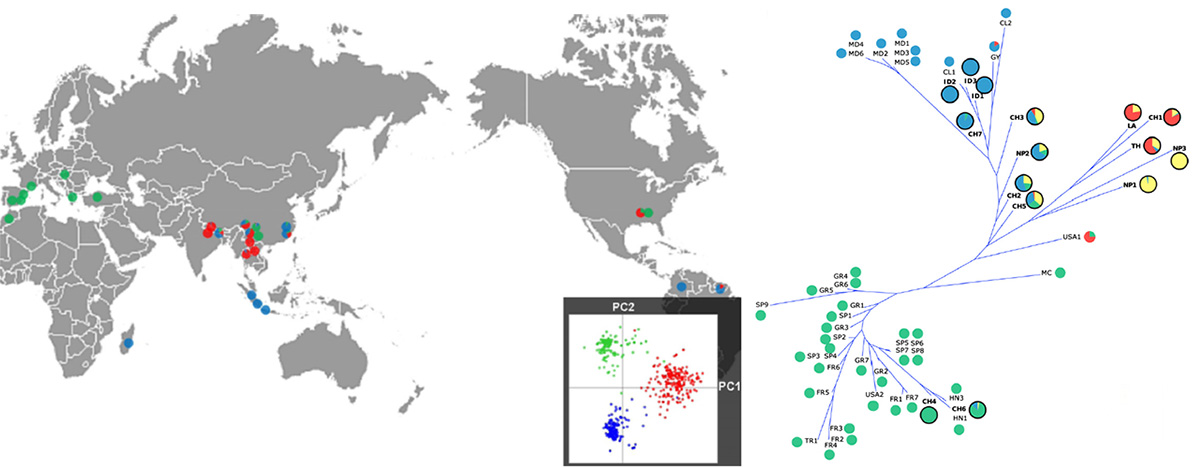
En ce qui concerne le gazon, une étude de 2001 utilisant des marqueurs moléculaires indique que les populations de P. Oryzae isolées sur raygrass anglais aux USA lors des premières grosses épidémies sont issues de seulement 3 lignées21(voir figure 3). Dans cette même étude, il a été démontré que ses souches étaient proches de celles isolées sur blé et triticale mais distinctes de celles isolées sur riz. Une étude similaire menée à la même époque indique que les souches isolées sur raygrass anglais sont distinctes de celles isolées sur digitaire, sétaire et riz22. Ces mêmes souches sont par contre proches de celles isolées sur fétuque élevée et dans une moindre mesure de celles isolées sur blé. Des infections croisées sont observées entre les différentes espèces21 (blé, triticale, raygrass anglais, fétuque élevée, voir figure 4). Les souches isolées sur raygrass anglais sont virulentes sur fétuque élevée, blé et triticale mais pas sur riz. Seules une souche isolée sur blé et une souche sur triticale sont virulentes sur raygrass anglais et fétuque élevée. Une étude plus récente109 fournit désormais plus d’explications : les souches de P. Oryzae présentes sur raygrass anglais sont très probablement à l’origine des épidémies de 2011 aux USA. En 2019, le CIRAD de Montpellier publie également une étude109 sur les cas de pyriculariose observés sur terrains de sports en France depuis 2016 et insiste sur l’utilité d’une surveillance des populations du pathogène : source de possibles épidémies sur le blé. Le raygrass anglais est ainsi une source d’inoculum potentielle de la pyriculariose pour les grandes cultures céréalières109, 110.
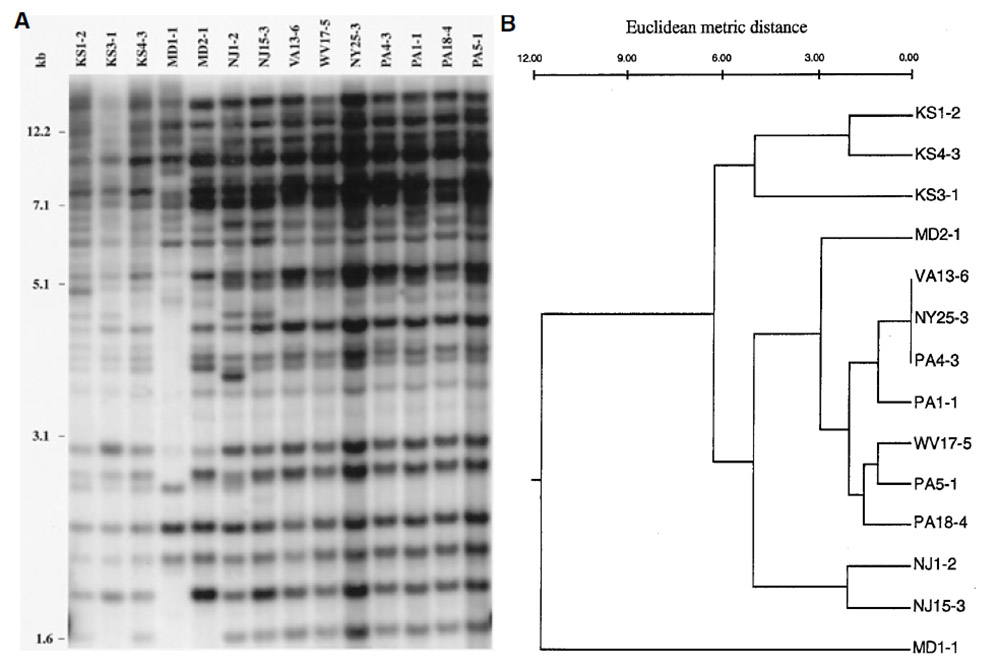
Un autre aspect important pour une meilleure compréhension des épidémies du pathogène et des solutions à mettre en œuvre porte sur son mode de reproduction. G. Viji et W. Uddin publient une étude en 2002 portant sur le type sexuel et le statut de fertilité de P. Oryzae23. Toutes les souches isolées sur raygrass anglais appartiennent à un seul type sexuel (MAT1-2) indiquant que les recombinaisons sexuelles sont très peu probables et que la reproduction est majoritairement asexuée. En effet, M. oryzae étant hétérothallique, il a besoin de deux types sexuels pour se reproduire sexuellement (MAT1-2 et MAT1-1). Ces résultats coïncident avec ceux d’une étude citée précédemment21. Enfin, aucune souche isolée sur raygrass anglais n’est capable de produire des ascospores (spores sexuées), quel que soit le stade de développement23. L’étude conclue sur la faible fertilité de P. Oryzae du fait de l’absence de fertilité femelle et de formation d’ascospore qui indiquent une reproduction exclusivement clonale des souches du pathogène23. Les souches à la base des épidémies sont donc probablement localisées (avec une éventuelle récurrence annuelle suivant les conditions climatiques). La variabilité génétique est faible (seulement 3 lignées21) la reproduction se fait par voie clonale (lignées clonales)21. Une étude similaire portant sur des souches isolées sur Saint Augustine Grass et fétuque élevée dans l’état de Géorgie aboutit aux mêmes résultats pour la fétuque élevée et tire strictement les mêmes conclusions24.
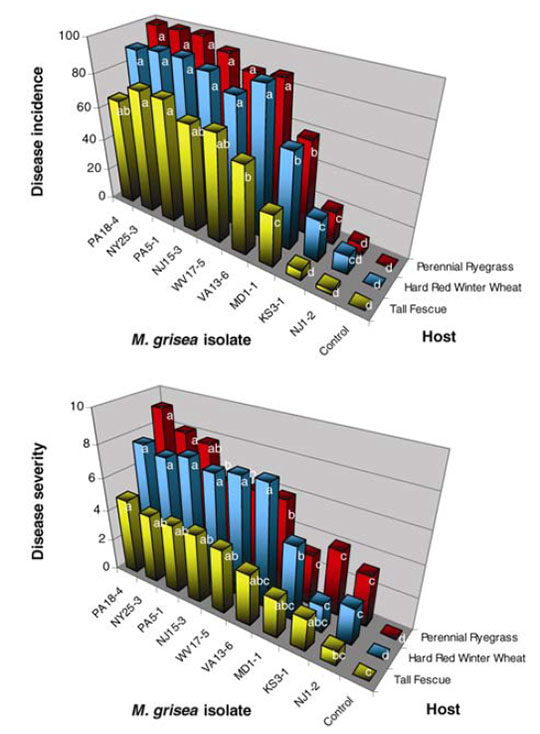
Une autre publication plus récente (2007) étudie le lien entre les souches isolées sur raygrass anglais aux USA et les souches isolées au Japon25. En effet, de 1996 à 1999, c’est-à-dire à la même époque des épidémies américaines, plusieurs foyers de Pyricularia oryzae furent signalés sur différents golf au Japon26,27. Il s’avère que les souches provenant des deux pays sont étroitement liées et dérivent du même ancêtre probablement responsable des épidémies rencontrées au Japon et aux USA. L’étude propose deux hypothèses concernant l’origine des épidémies :
- Considérant les importations de semences de gazon produites aux USA par le Japon et considérant la possible propagation de P. Oryzae par les semences7,28, des souches provenant des USA ont pu être importées au Japon.
- Une propagation par voie aérienne des spores de manière indépendante aux USA et au Japon par une source commune non identifiée.
Enfin, l’étude la plus récente16 (2010) concernant la génétique de P. Oryzae apporte de nouveaux éléments. Alors qu’il était admis que l’origine des épidémies signalées dans l’Ouest des USA provenait des premiers foyers de Pyricularia oryzae identifiés plusieurs années plutôt dans l’Est, la publication va dans le sens de souches endémiques devenues pathogènes du fait de conditions météorologiques et pratiques culturales particulières en Californie. Les chercheurs s’appuient principalement sur la diversité génétique plus élevée des souches isolées sur raygrass anglais en Californie par rapport aux souches isolées dans l’Est américain. Dans le cas d’une épidémie propagée depuis l’Est américain, un appauvrissement génétique aurait dû être constaté, or ce n’est pas le cas ici. De plus, l’étude met en avant le contraste de diversité génétique entre Kikuyu (élevé) et raygrass anglais (faible). Enfin, les chercheurs réalisent la première observation de souches disposant des deux types sexuels (MAT1-1 et MAT1-2) isolées sur Kikuyu avec une forte diversité génétique. Cette propriété était jusque-là connue pour M. oryzae isolé sur riz et implique donc un potentiel de reproduction sexuée pour le champignon pathogène sur Kikuyu.
Ce qu’il faut retenir
- L’origine exacte de Pyricularia oryzae est encore mal identifiée.
- Son mode de propagation s’effectue probablement et majoritairement par voie aérienne même si les semences ou d’autres espèces considérées comme « mauvaises herbes » peuvent représenter une source d’inoculum.
- La reproduction est strictement clonale ce qui implique une faible diversité génétique et donc potentiellement la propagation de souches identiques sur l’ensemble des territoires touchés.
Historique
Historique aux USA
P. Oryzae était déjà connu des américains sur Saint Augustine Grass (Stenotaphrum Secundatum) depuis la fin des années 50 avec différents rapports concernant ce champignon sur l’espèce de gazon29,30. A cette époque, le problème se restreignait aux pelouses ornementales trop irriguées et fertilisées composées de Saint Augustine Grass (voir figure 5)31. La maladie était plutôt commune et les dégâts visibles n’étaient pas comparables à ceux observés plus tard sur raygrass anglais32. Par conséquent, la maladie était alors appelée « Gray Leaf Spot» et non « Blast» car elle n’était pas aussi rapide et généralisée que dans le cas du riz ou du blé33.

Les premières grosses épidémies ont d’abord été détectées sur raygrass italien fourrager (Lolium multiflorum) aux Sud des USA en Louisiane et dans le Mississipi au début des années 7011,34. Ces épidémies sont localisées et se succèdent annuellement35.
Les signalements du champignon pathogène aux USA sur gazon datent de 1991 avec le raygrass anglais36. La maladie était d’abord confinée dans le Sud-Est de la Pennsylvanie (Nord-Est des USA) avec une détection sur raygrass anglais des fairways de golfs32,36. En 1998, elle a ensuite été signalée pour la première fois dans l’Ouest de l’état avec des attaques sévères atteignant des pertes de plus de 90% du raygrass anglais des fairways de certains golfs de la région32(voir figure 6). Durant la même période, d’autres états américains signalent des attaques plus ou moins sévères du champignon pathogène principalement dans le Nord-Est du pays37–40 et plus tard à l’Ouest (à partir des années 2000) avec l’exemple de la Californie et du Nevada41,42 sur fairways de golfs et terrains de sports. Les principales années avec des dégâts réellement importants dans les régions citées sont 1995, 1998 et 200033. Sur fétuque élevée, la maladie a été signalée pour la première fois au Sud-Est des USA en 199643. Enfin, sur Kikuyu, les premiers cas identifiés sur des golfs datent de 2003 en Californie44. La plupart des années à problème, les épidémies sont signalées dans les mêmes foyers que les années précédentes avec une incidence dépendant de la rigueur des hivers précédents31,45.
Exemple de l’apparition de la maladie dans l’Ouest américain
En 1996, le « Rice Blast », sérieuse maladie du riz causée par Pyricularia Oryzae apparu pour la première fois dans la vallée de Sacramento en Californie46. Cinq ans plus tard en 2001, Gray Leaf Spot fut détecté sur raygrass anglais sur golf et terrain de sports de la même région31. Pourtant, les scientifiques pathologistes indiquent à l’époque que les souches isolées sur le riz ne sont pas pathogènes des espèces de gazon. En 2002, le champignon ne fait aucun dégât. En 2003, de brefs mais intenses orages en Juillet couplés à des températures de plus de 32°C sont à l’origine de nombreux foyers de Pyricularia oryzae en Californie sur raygrass anglais des fairways et roughs de golf mais également et pour la première fois sur Kikuyu44. Les attaques semblent toutefois localisées sur certaines régions de l’état. En 2004, seulement 11 foyers sont détectés mais les localisations s’étendent progressivement à l’ensemble de l’état31. En 2005, 17 foyers sont détectés sur Raygrass anglais et Kikuyu. Les pluies plus abondantes de l’hiver 2004 expliquent sûrement la meilleure survie du champignon et les attaques plus importantes de l’été 2005. En Août 2005, un cas de Pyricularia oryzae est signalé sur un fairway de Golf de Las Vegas composé à 100% de raygrass anglais après 2 semaines de températures supérieures à 32°C et deux jours de pluies intenses. Malgré les conditions arides de la région, les températures élevées, les deux jours de pluies intenses et l’irrigation abondante nécessaire à maintenir une humidité au sol suffisante pour le raygrass expliquent sûrement l’apparition de la maladie.

Depuis l’apparition de la maladie en Pennsylvanie en 199236, les foyers se sont propagés de l’Est américain jusqu’à l’Ouest américain. P. Oryzae est capable de se propager sur de longues distances par le vent ou par la dispersion des spores par l’eau de pluie ou d’irrigation. Le champignon peut survivre dans les débris végétaux, le feutre ou vieux plants de gazon aussi bien que dans les graines. Cependant, celles-ci ne semblent pas avoir joué de rôle important dans la propagation de la maladie aux USA puisqu’aucune trace de Pyricularia n’a été détectée sur les graines de gazon produites dans les régions de production (principalement Oregon)31. Les souches de l’Est américain ont pu provenir des foyers Ouest américains en se propageant par le vent ou débris végétaux où peuvent également provenir des souches locales présentes sur Saint Augustine Grass ou d’autres graminées hôtes.
Depuis sa découverte en 1991, la maladie a généré des coûts supplémentaires sur les fairways des golfs touchés d’environ 20 à 25 000$ par an et le manque à gagner de certains golfs a été estimé jusqu’à 500 000$33.
Historique en France
Les premiers cas identifiés de pyriculariose en France datent de 2016 sur les pelouses de ligue 13,47 avec des pelouses touchées durant le mois d’Août. Selon le réseau d’épidémio-surveillance : « cette maladie s’est manifestée avec des températures supérieures à 28°C et l’irrigation fréquente en été et la sur-irrigation consécutive à la reprise de la compétition ». Des explications sur la maladie dans les bulletins d’alerte évoque la difficulté du diagnostic : « dans un premier temps les laboratoires ont identifié les agents causaux Xanthomonas transluscens ou du Pythium (présents à l’analyse le Xanthomonas transluscens est plutôt une maladie de faiblesse) le véritable agent causal est bien Pyricularia grisae ». En 2017 sont également signalés plusieurs cas de la maladie mais dans une moindre mesure. C’est en 2018 que l’épidémie est la plus violente avec la plupart des stades touchés par la maladie et une médiatisation assez forte1–3,5.

Certains gestionnaires expliquent la propagation du champignon par les crampons des joueurs suite à l’Euro 2016 et d’autre par les semences en provenance de pays déjà touchés par la maladie3. Tout comme aux USA à la fin des années 1990, les attaques sont rapides et intenses en 2018 (voir figure 7) rendant les pelouses parfois totalement impraticables avec des reports de matchs. A l’époque, la communication autour de la problématique n’est pas claire et les critiques plutôt violentes. Il semble tout de même probable que le champignon mal connu en Europe sur le gazon explique une anticipation de l’épidémie pas vraiment à la hauteur.
En 2017, le CIRAD isole 4 souches du pathogène sur le stade de la Mosson (Montpellier) et réalise avec succès des tests de pathogénicité sur des variétés de raygrass anglais. Le pathogène isolé est bel et bien identifié génétiquement comme Pyricularia Oryzae. Les résultats sont publiés en 2019 dans le journal « Plant Disease« 110. C’est ainsi la première étude officielle validant la présence du pathogène sur les gazons des stades du territoire français depuis 2016. Elle met en garde sur la nécessité de suivre l’évolution du pathogène sur gazon, possible source d’inoculum sur blé.
En 2020, 5 souches prélevées par mes soins sur un stade de Ligue 1 sont isolées par le CIRAD et l’équipe de Didier Tharreau. Celles-ci serviront pour d’éventuels essais de sensibilité/d’efficacité ou d’analyse génétique du champignon. Cette même année, des symptômes de la maladie sont même observée à fin Septembre en Rhône-Alpes sur raygrass anglais et fétuque élevée (terrain de sports) après un week-end frais (entre 6.2 et 14°C) et pluvieux (cumul des précipitations : 28 mm). Cette dernière remarque interroge ainsi sur les capacités du champignon à se développer à plus faibles températures. En 2019, les symptômes étaient parfois visible jusqu’à mi-octobre sur certains stades de Ligue 1.
Historique en Europe
En Allemagne, la première détection de Pyricularia oryzae sur gazon date de 2017 (Sabine Braitmaier (ProSementis GmbH)) sur terrain de sports. En Angleterre, Kate Entwistle (http://www.theturfdiseasecentre.co.uk/) identifie Pyricularia pour la première fois en Août 2020 sur raygrass anglais111. Cette dernière observation indiquerait que le champignon est capable de s’adapter à des températures plus faibles ou que les températures en angleterre deviennent suffisamment douces pour permettre le développement du pathogène.
Symptômes
Pyricularia oryzae provoque des dégâts plus importants sur jeunes pousses de raygrass anglais que sur gazon mature. Il se développe sur les feuilles en commençant par de petites lésions donnant un aspect « mouillé » qui se transforment ensuite en petites tâches foncées de 1 à 3mm de diamètre. Ces tâches s’étendent rapidement à l’ensemble du feuillage et deviennent gris, gris-marron ou marron clairs, plutôt circulaires avec des bords marron foncé entourées d’un halo jaune (voir figure 8)32. Les lésions nécrotiques se rejoignent ensuite et prennent des formes irrégulières, causant des nécroses partielles ou complète des feuilles. Les feuilles nécrosées peuvent également devenir flasques ou torsadées. Lorsque la nécrose atteint l’ensemble des feuilles, elle aboutit à la mort de la plante32. Il n’y a pas d’infection évidente du plateau de tallage. Les feuilles touchées peuvent parfois prendre un aspect gris-blanc hâlé et une texture sableuse lorsque les conidies sont produites abondamment. Le mycélium aérien n’est pas visible facilement sur les feuilles en conditions humides.

Les gazons touchés ont l’air décolorés, flétris ou séchés. Cet aspect est suivi par le développement de zones creuses ou de patchs irréguliers de grande taille. Lors d’invasions sévères, l’intégralité de la pelouse peut être détruite en seulement quelques jours33, ne laissant plus que d’irrégulières tâches de pâturin annuel ou d’autres mauvaises herbes sur les fairways ou les stades. Les zones touchées peuvent se répartir sur les creux, dépressions ou le long des drains où une forte humidité et une humectation prolongée des brins a lieu.
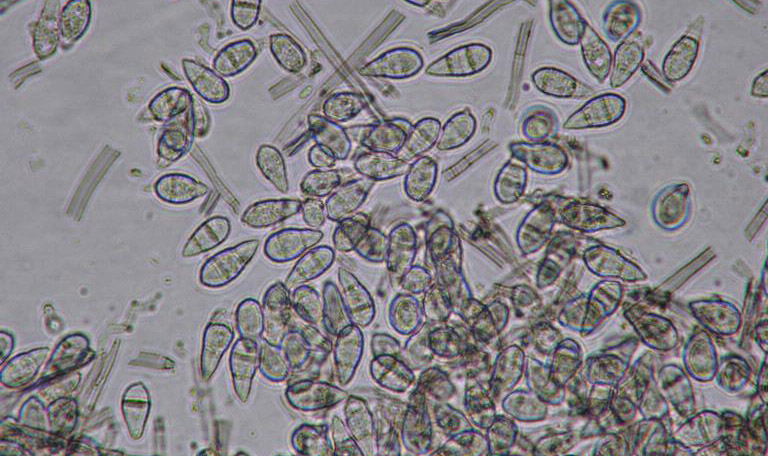
Le diagnostic de Pyricularia oryzae est en général confirmé par la présence de conidies (spores asexuées, voir figures 9 et 10) caractéristiques dans les tissus foliaires : transparentes, pyriformes et septées (1 à 3 cloisons). Ces conidies sont regroupées par 3 à 5 à l’extrémité des conidiophores48. La difficulté majeure dans l’étude microscopique des symptômes de P. oryzae réside dans l’absence des spores dans certains cas dans les tissus infectés. Les échantillons de feuilles suspects requièrent une incubation dans une chambre humide jusqu’à 48 heures afin d’induire la sporulation du pathogène.
Pourtant, une méthode immunologique rapide utilisant un anticorps monoclonal permettant de détecter P. oryzae a été développée49 en 2003. Cette méthode de détection possède un intérêt pratique et pourrait être utilisée comme kit diagnostic pour des échantillons de gazons suspects. Dans cette méthode, l’anticorps monoclonal ne réagit pas avec les antigènes de Rhizoctonia solani, Bipolaris sorokiniana et Pythium aphanidermatum. En effet, ces 3 champignons pathogènes sont souvent présents lors des périodes propices au Gray Leaf Spot et les symptômes causés sont souvent similaires33. Ainsi, la méthode est efficace pour détecter P. oryzae lorsque les symptômes foliaires se développent mais pas lors de la période d’incubation.
Une autre méthode de détection basée sur les réactions en chaîne par polymérase (PCR) a également été développée et permet un diagnostic fiable de P. oryzae en 4 à 8 heures50. Des laboratoires équipés pour les méthodes PCR existent en France (notamment le laboratoire IAGE avec la PCR digitale) et peuvent réaliser ce genre de diagnostic, le coût reste cependant élevé (voir le paragraphe sur le diagnostic plus bas).
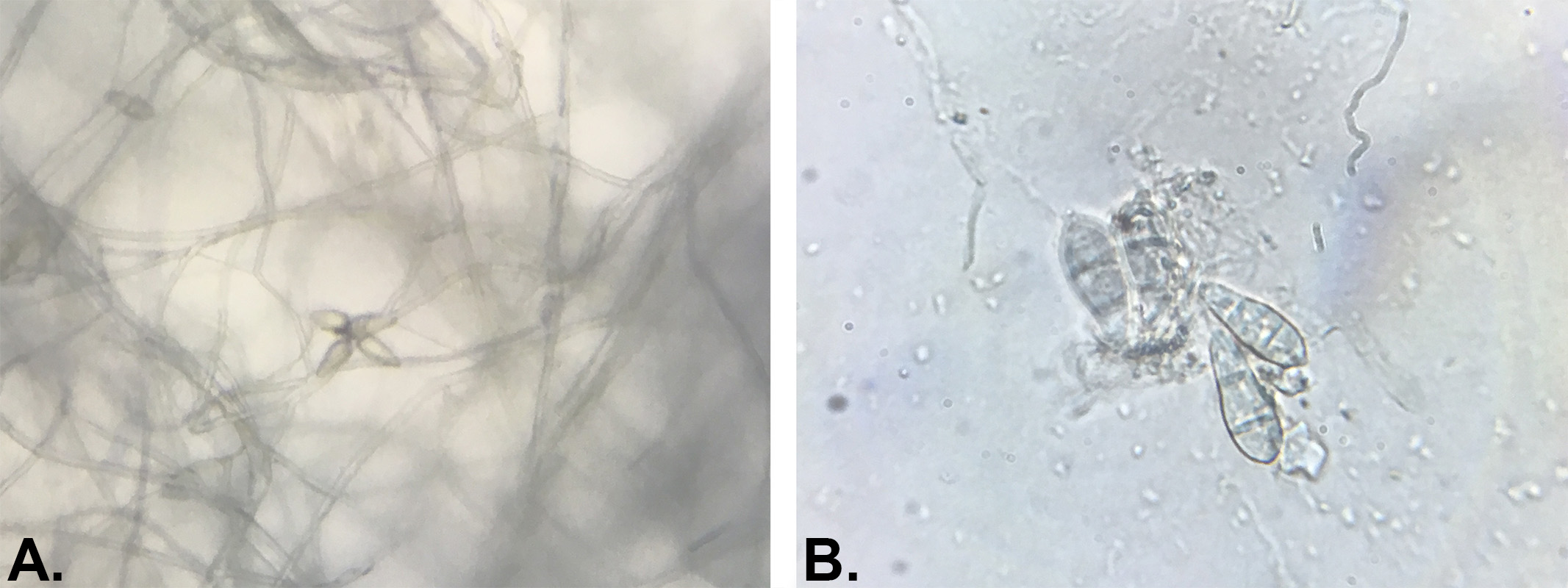
Enfin, une méthode de détection basée sur un capteur électro-chimique permettrait une détection rapide, fiable et à coût limité de P. Oryzae sur riz avant les premiers symptômes visibles51. A priori, elle pourrait également être transposable au gazon mais à ma connaissance, elle n’a pas encore été développée ni commercialisée.
Pour voir des photographies des symptômes de la maladie développée sur terrains de sports, consulter la rubrique dédiée visible à la fin de cet article.
Cycle et conditions favorisant le développement du pathogène
P. oryzae survit à l’hiver par le biais de mycélium dormant et conidies (spores asexuées) stockés dans les débris de plantes mortes ou potentiellement sur des semences33. Une étude réalisée par P. Harmon et R. Latin a montré que la survie de P. oryzae était largement réduite lors de la période hivernale mais il leur était cependant facile d’induire la sporulation de débris de plantes mortes le printemps suivant52. Les conidies produites sur les débris servent en effet de source d’inoculum au printemps suivant. Les régions où les hivers sont froids sont donc peu propice à la survie et au développement du champignon pathogène alors que les régions plus tempérées aux hivers doux sont plus à risque en ce qui concerne la survie et donc la répétition annuel des épidémies de Pyricularia oryzae. Il est également utile de préciser que P. oryzae est peu saprophyte d’où une faible production de conidies au printemps lorsque la compétition avec les autres microorganismes est élevée52. Il est également fortement probable que l’origine de certains foyers d’infection soit une dispersion par voie aérienne des conidies ayant passé l’hiver dans des régions plus douces. Le champignon est polycyclique (plusieurs cycles sont possibles dans la même saison) et fortement dépendant des conditions environnementales pour démarrer l’infection53.
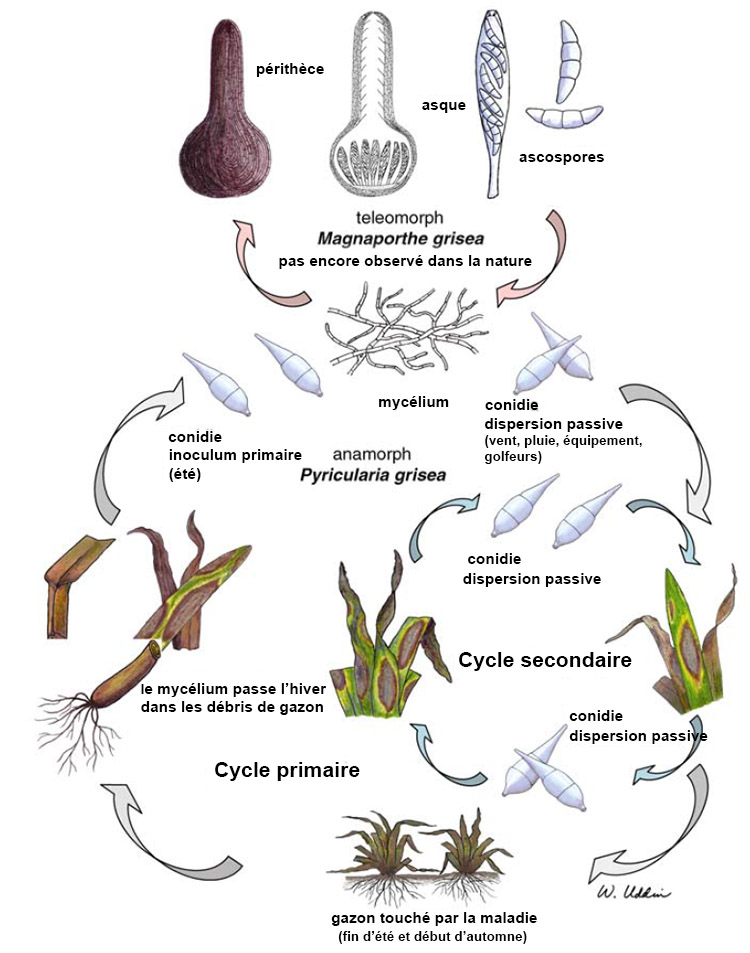
Basé sur des observations de terrain, les chercheurs émettent l’hypothèse que P. Oryzae commence à se développer sans symptômes visibles en début d’été ou en fin de printemps. Les conidies produites sur les feuilles infectées durant cette période déclenchent une série d’infections secondaires qui contribuent à la création d’inoculum pour l’été où les épidémies démarrent33.
Pyricularia oryzae est d’abord souvent observé sur les roughs dont les hauteurs de tonte sont plus élevées. Ces zones sont souvent partiellement à l’ombre avec une humidité ambiante et des rosées prolongées favorisant les infections. La maladie peut d’ailleurs souvent être détectée sur les roughs plusieurs jours avant les dommages majeurs visibles sur les fairways33. La maladie est également couramment observée sur les pentes orientées aux Sud sans ombre, pouvant sécher dans la journée73.
La dispersion de l’inoculum (conidies) se fait par le vent, la pluie, l’eau d’irrigation, les machines de maintenance mais également par les chaussures des joueurs ou de l’équipe de maintenance. Bien que la propagation par les semences soit clairement établie sur la culture du riz7,28, aucune étude n’a pu établir le lien entre semence et dispersion de Pyricularia oryzae pour le gazon33.
Pyricularia oryzae se développe en général entre début juillet et mi-octobre suivant les régions. Son développement est favorisé par des conditions chaudes et humides rencontrées à cette période de l’année. Les conditions environnementales et la quantité d’inoculum disponible pendant cette période de fin d’été sont les deux facteurs déterminants dans le développement des épidémies33. Plusieurs études ont tenté d’établir le lien entre les conditions météorologiques et le développement du pathogène. En ce sens, la durée d’humidité foliaire et la température ont été identifiées comme les paramètres environnementaux influençant le plus le développement de Pyricularia oryzae54. La première publication date de 1987 et étudie le raygrass italien fourrager55 tandis que les autres datent des épidémies sur gazon avec le raygrass anglais36,56 et fétuque élevée57. Ces études montrent toutes que l’optimal de température pour le développement du pathogène se situe entre 26 et 29°C. W. Uddin54 découvre notamment que l’effet de la température sur l’incidence et l’intensité de Pyricularia oryzae est cubique, indiquant qu’incidence et intensité augmentent avec la température pour un maximum de 28°C. L’humidité du feuillage est également important dans le développement de la maladie54,57. W. Uddin démontre que l’intensité des attaques augmentent avec la durée d’humidité du feuillage pour toutes les températures54. Une durée inférieure d’humidité du feuillage est notamment requise pour le développement de la maladie pour des températures élevées. A 28°C, température optimale pour le développement du pathogène, une durée minimale de 4 heures d’humidité au niveau du feuillage est requise pour déclencher une attaque54. L’équipe de chercheurs propose également un modèle de régression polynomial pouvant servir à anticiper le développement de la maladie suivant la température et l’humidité au niveau du feuillage.
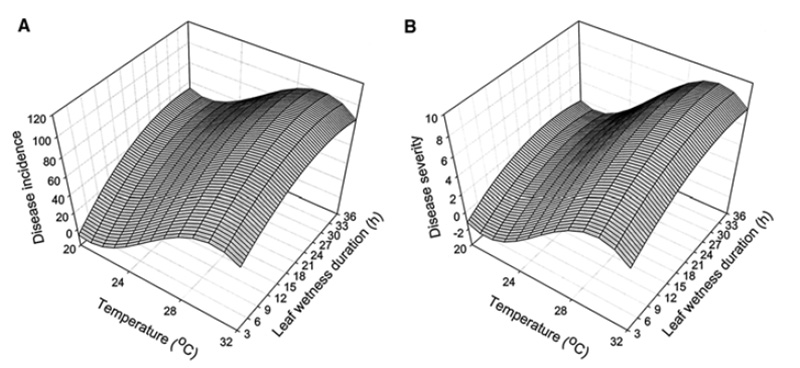
Enfin, en plus de la durée d’humectation du feuillage, l’humidité relative est un autre paramètre climatique influençant le développement de Pyricularia oryzae. Ce paramètre mesurable et prévisible, a été largement étudié et utilisé dans différents modèles pour prédire le développement de champignons pathogènes dans bien des systèmes de cultures58,59. La durée d’humidité foliaire peut d’ailleurs être estimée par le biais de la durée d’humidité relative élevée (période lors de laquelle l’humidité relative est supérieure à 90%)60. Bien que l’expansion des lésions nécrotiques soit rapide dans des périodes humides du feuillage, les conidies (spores asexuées) ne sont pas produites si une humidité excessive est présente sur les tissus foliaires33. C’est le cas des fortes rosées par exemple. Le retrait de l’humidité foliaire ou de la rosée est donc nécessaire lors des conditions de forte humidité pour que la production de conidies démarre.
Une étude menée sur P. oryzae avec le riz a montré que la production de conidies était faible pour une humidité relative de 90% et plus favorable à 93% pour des températures comprises entre 16 et 34°C58.
Une autre étude récente étudie l’impact de l’humidité relative sur l’infection, la colonisation et la production de spores de P. oryzae sur raygrass anglais56. Les résultats montrent qu’une humidité relative supérieure à 92% est nécessaire pour l’infection à 28°C. Aucune formation d’appressorium (système utilisé par les champignons pour pénétrer dans une cellule hôte) n’est détectée pour des humidités inférieures à 88%, seule la formation de très petits tubes germinatifs est observable. La biomasse fongique est maximale pour une humidité relative de 100% alors qu’aucune biomasse n’est mesurée pour une humidité inférieure à 88%. La production de spores est observée lorsque l’humidité relative est supérieure à 96% avec la production la plus élevée 8 jours après l’inoculation. L’étude indique donc que l’infection et la production de spores de P. oryzae sur raygrass anglais requiert différents seuils d’humidité relative : 92% et 96% respectivement pour l’infection et la production de conidies.
En conclusion, le développement de Pyricularia oryzae est sous forte influence des conditions climatique. Pour des attaques sévères de pyriculariose, les conditions suivantes doivent être réunies :
- Des températures comprises entre 20 et 35°C avec un optimum à 28°C54
- Une humidité relative de 92% pour permettre l’infection56
- Une humidité relative supérieure à 96% pour permettre production de spores56
- Une humidité foliaire d’une durée supérieure à 4h pour une température de 28°C et d’environ 10h à 24°C54.
Ainsi, des journées et nuits chaudes avec une succession de fortes humidités foliaires puis de séchages (arrosages conséquents ou épisodes orageux), combiné à des humidités relatives élevées sont les principaux facteurs contribuant au développement d’épidémies de Pyricularia oryzae33.
Il est donc facile de comprendre pourquoi les épidémies du pathogène ont eu lieu dans de nombreux stades français les derniers étés. Le gazon est en général rafraîchi par des arrosages conséquents suite aux fortes températures de la journée. Si ces arrosages sont effectués en fin de journée ou dans la nuit, les conditions idéales pour le développement du champignon pathogène sont réunies. Les tribunes ajoutant de l’ombre sur certaines zones du terrain empêchent de plus au gazon de sécher correctement en journée et constituent sans doute un inoculum redoutable pour le reste du terrain.
Ce qu’il faut retenir
- P. Oryzae passe l’hiver sous forme de mycélium dormant ou spores dans les débris végétaux.
- Les hivers rigoureux ne permettent pas une bonne conservation du pathogène qui ne donne en général pas lieu à de fortes épidémies.
- Le risque est plus élevé dans les régions où les hivers sont doux.
- Le développement du pathogène est fortement dépendant des paramètres climatiques : températures et humidité relative. Il nécessite des valeurs particulières de ces deux paramètres pour infecter le raygrass anglais et déclencher la production de spores. C’est pourquoi les épidémies sont en général très localisées.
Stratégies de lutte contre le pathogène
Avant d’évoquer les stratégies de lutte contre la pyriculariose, il est nécessaire de préciser qu’il est au préalable indispensable de réaliser le bon diagnostic lorsque les symptômes deviennent visibles. En effet, aux premiers stades, la maladie peut se confondre avec d’autres pathogènes du gazon.
Une fois ce diagnostic fait, différents leviers disponibles pour l’intendant existent pour contrôler Pyricularia oryzae. Les mesures les plus durables sont préventives. Des moyens de contrôle chimiques existent et donnent les meilleurs résultats en cas d’attaques sévères. Ces outils de contrôle chimiques potentiels devraient être utilisés avec intelligence dans un programme de rotation et dans un cadre général de réflexion autour des stratégies de lutte. De plus, l’utilisation de fongicide ne résoudra pas le problème au long terme puisque l’inoculum (mycélium dormant, spores) est toujours présent et n’attend que les conditions environnementales propices pour se développer à nouveau.
Les mesures préventives quant à elles s’articulent autour du choix des espèces et des cultivars, des produits de biocontrôle, des opérations mécaniques et autres outils physiques mais également autour de la fertilisation.
A l’heure actuelle, la méthode préventive qui donne les meilleurs résultats réside dans le choix de d’espèces ou cultivars résistants. Il est important d’insister sur ce point car étant donné la rapidité de développement du champignon pathogène, les autres méthodes préventives ne donnent pas de résultats satisfaisants et suffisants pour obtenir un gazon sain de manière durable. Quasiment 30 ans d’expérience avec ce champignon aux USA a abouti à cette conclusion.
Diagnostic fiable : l’observation microscope ou la PCR
Comme évoqué dans le paragraphe précédent, la première étape nécessaire avant de mettre en places des mesures préventives ou curatives consiste en un diagnostic fiable. Avec un œil expérimenté, il est possible de reconnaître les symptômes mais l’observation visuelle ne garantit jamais une fiabilité de 100%.
L’observation microscopique
Le premier diagnostic fiable repose sur une observation macroscopique puis microscopique des symptômes. Un échantillon de gazon touché par la maladie peut être observé à la loupe binoculaire puis au microscope optique afin de détecter des éléments morphologiques caractéristiques du champignon. Cette méthode est fiable et rapide mais nécessite des compétences et une expérience en la matière. Vous pouvez me contacter en cas de besoin. Il suffit de m’envoyer un échantillon de gazon symptomatique par chronopost. En règle générale, l’échantillon arrive sous 24 à 48 heures et je peux réaliser le diagnostic dans la journée.
Les outils de biologie moléculaire : la PCR
Les outils de biologie moléculaires se sont fortement développés ces dernières années. Les techniques d’amplification des acides nucléiques (PCR) montrent une efficacité redoutable pour ce type de problématique. Il est actuellement possible de détecter de nombreux pathogènes en utilisant ces méthodes à partir d’un échantillon symptomatique de gazon. Il suffit alors d’envoyer un ou plusieurs échantillons malades dans un laboratoire qui réalise ce genre de prestation pour obtenir des résultats assez rapidement.
En France, citons notamment le laboratoire IAGE qui réalise ce type de diagnostic. Le laboratoire a développé en 2023 en collaboration avec le CIRAD un système de détection du pathogène par PCR digitale. La résolution de cette technologie permet notamment la détection du pathogène avant les premiers symptômes visibles. En effet, la résolution de la PCR digitale est plus élevée que celle de la PCR quantitative (qPCR). De manière imagée, alors que la PCR quantitative peut détecter une pierre dans une botte de foin, la PCR digitale quant à elle détecte plus petit qu’une tête d’épingle.
Le laboratoire propose ainsi à travers sa « DIAGBOX » la détection précoce de la pyriculariose par le biais de lingettes stériles à frotter sur les lames de tondeuses et à envoyer au laboratoire (ce dernier collabore avec un transporteur frigorifique rapide et efficace). IAGE garantit un résultat d’analyse à 72 heures.
Un diagnostic plus classique de détection par PCR digitale sur un gazon déjà symptomatique est également proposé par la société. Enfin, une fois la maladie déclarée, IAGE a développé un système de suivi quantitatif de l’inoculum avec des analyses régulières sur déchets de tonte afin de vérifier l’éventuelle efficacité des traitements ou solutions mises en place pour lutter contre le pathogène.
La méthode de détection précoce est un réel atout dans la gestion de la maladie. Le principe repose sur le fait qu’un traitement est plus efficace sur un stade précoce de développement du pathogène. Pour optimiser l’efficacité, je recommande une fréquence d’analyse élevée (2 à 3 tontes analysées par semaine). En effet, si la fréquence hebdomadaire est trop faible, il se peut que le gain de temps obtenu ne soit pas si significatif par rapport à une détection symptomatique classique. En effet, il faut compter le délai entre la tonte analysée et la réelle date d’apparition du champignon puis le délai d’envoi et réception par le laboratoire et enfin le délai d’analyse ce qui peut faire perdre un temps précieux par rapport à l’efficacité des traitements.
Pour en savoir plus sur cette solution, vous pouvez regarder le second épisode de « mon Podcast « le gazon en long et en large » où j’invite Olivier Courot « business development manager » du laboratoire IAGE.
Mesures physiques préventives
Suite aux nombreux cas de Pyricularia oryzae sur les stades français durant l’été 2018, différentes solutions sont évoquées concernant la prévention de l’apparition de la maladie dans un court article publié sur le site « Gazon Sport Pro H24 »61. A travers cet article, c’est la société Hydraparts qui propose des solutions bien entendues non exhaustives dites « mécaniques ». Elles constituent une première série de stratégies pouvant être mises en œuvre principalement dans les stades.
Réduction de l’humidité foliaire
La première méthode consiste à limiter la durée d’humidité foliaire, paramètre important dans le développement de la maladie évoqué plus haut. Ce principe n’est pas spécifique de P. oryzae mais valable sur la plupart des champignons pathogènes. Les ventilateurs désormais disponibles et déjà utilisés dans différents stades à l’heure actuelle permettent un séchage relatif du brin et une limitation des périodes d’humidité prolongées. La société SGL commercialise un ventilateur déjà utilisé dans différents stades en France et à l’étranger : le modèle TC50 .

D’autres stades utilisent le ventilateur de la société Bernhard avec le modèle Turfbreeze.
Enfin, plusieurs autres stades comme Bordeaux, Toulouse, Rennes ou Montpellier utilisent ou ont utilisé des ventilateurs de la société Aveltec avec le modèle Mistral 40.
Aucune étude scientifique publiée à l’heure actuelle n’est disponible concernant l’efficacité de ces machines mais le principe simple et des années d’utilisation dans certains pays dans les golfs ou stades a permis au procédé de faire ses preuves. Bien évidemment, l’utilisation de ce type de matériel est envisageable sur des surfaces réduites comme les stades ou les greens mais n’est pas adaptée aux fairways de golfs.
Par expérience, la plupart des ventilateurs disponibles permettent surtout une diminution de la température foliaire lors du passage du flux d’air. L’efficacité est plus élevée si le nombre de ventilateurs est suffisant pour garantir un temps minimal d’absence de flux d’air sur chaque mètre carré du gazon. La réduction de la température foliaire implique probablement une diminution du stress pour des graminées inadaptées à des températures supérieures à 30°C comme le raygrass anglais. En cas d’humectation foliaire prolongée, ce stress est à mon sens un élément déclencheur de la maladie.
L’effet sur l’humidité foliaire est quant à lui plus modéré. En cas de forte humidité foliaire (rosée ou temps pluvieux) il ne faut pas attendre de ces ventilateurs de « sécher » rapidement le gazon. Dans le cas d’un nombre limité de ventilateurs (moins de 6 voire 8 pour le modèle TC50 de SGL) l’effet séchant sur une forte humidité foliaire est très modéré voire inexistant.
L’utilité des ventilateurs est donc modérée vis-à-vis de la pyriculariose en réduisant la température foliaire (réduction du stress thermique) et en asséchant modéremment la surface foliaire (réduction du temps d’humectation). Les ventilateurs s’intègrent donc dans un plan de gestion global mais ne suffisent pas à limiter le développement de la maladie.
Pour en savoir plus sur l’effet des ventilateurs sur la réduction des températures, vous pouvez regarder la vidéo visible ci-dessous que j’avais réalisé sur un stade équipé de 4 ventilateurs.
Ultraviolets
Une seconde méthode envisageable est l’utilisation de certaines longueurs d’onde de rayons ultraviolets (UV-C) qui sont toxiques pour les spores et le mycélium des champignons pathogènes en général et déclenchent les mécanismes de défenses du gazon. La technique est prometteuse mais le recul est encore faible par rapport à l’efficacité sur la pyriculariose du gazon. Bien que des publications existent en production fruitière ou en maraîchage62–68, aucune étude publiée n’a jamais encore été validée sur la pyriculariose du gazon.
Effect fongistatique des ultraviolets
En ce qui concerne la toxicité directe sur les champignons pathogènes, un des challenges techniques réside dans le temps d’exposition aux UVs puisque la toxicité pour les champignons pathogènes dépend de l’intensité lumineuse et de la durée d’exposition. Or, les machines disponibles ont une largeur limitée et une vitesse d’avancement qui ne permettent que des temps d’exposition limités. Il est donc peu probable qu’une réelle désinfection soit possible, tout au mieux une faible limitation de l’inoculum. De plus, les rayons agissent lorsqu’ils touchent directement leur cible. De ce fait, les parties « cachées » dans la canopée ou en surface du sol non exposées aux rayons UV ne sont pas traitées. Il apparait ainsi compliqué de pouvoir limiter significativement l’inoculum du pathogène par effet direct des rayons ultraviolets.
Citons le modèle UVC180 de la société SGL qui émet des rayons ultra-violets sur les surfaces engazonnées.
Effet stimulant des défenses naturelles
En ce qui concerne l’effet de stimulation des défenses naturelles, seuls les « flash ultraviolets » semblent donner des résultats démontrés scientifiquement112-113. Ces flashs consistent en une intensité lumineuse très élevée d’ultraviolets sur un temps court qui déclenchent les mécanismes de défense des gazons. A ce jour, seule la société française UV-Boosting commercialise un système tracté (Helios Gazon) utilisant ce principe de flash UV. Pour en savoir plus, vous pouvez écouter le podcast que j’ai réalisé avec la société UV-Boosting.
Opérations mécaniques
Sans entrer trop dans les détails, il est encore utile de rappeler que les opérations mécaniques permettent en amont :
- D’aérer les substrats et d’apporter suffisamment d’oxygène pour diminuer le risque d’apparition des pathogènes (toutes les opérations mécaniques).
- D’augmenter la perméabilité du milieu par le biais de fentes ou puits de carottages et donc de diminuer l’humidité dans le substrat et au niveau foliaire (couteaux, pointes, louchets creux).
- D’extirper du feutre (défeutrages profonds, verticuts, aérations à louchets creux) et donc du mycélium dormant et des spores qui constituent l’inoculum des prochaines épidémies.
A noter que ces opérations sont absolument déconseillées lors des semaines de canicules avec des températures supérieures à 30°C. En effet, dans ce cas l’aération devient un stress intense supplémentaire en permettant l’arrivée d’air chaud directement autour du système racinaire. Ces opérations sont donc à réaliser en amont afin d’obtenir une surface aérée, perméable peu propice à la survie de l’inoculum tout au long de la saison et particulièrement lors de la saison froide.
Il est enfin important de préciser que ces opérations mécaniques ne doivent en aucun cas être effectuées une fois la maladie déclarée. En effet, les louchets, pointes et autres couteaux sont d’excellents vecteurs de la maladie qui peut alors se propager sur d’autres zones sur le terrain. C’est également le cas des tontes qui favorisent « l’étalement » de la maladie (voir image ci-dessous).

Hauteur de tonte et déchets de tonte
Les résultats d’expérimentations autour de la hauteur de tonte en ce qui concerne le développement de P. oryzae sont contradictoires. Il est clair que l’incidence du champignon pathogène est élevée sur des gazons avec des hauteurs de tontes plus élevées (stades, fairways, roughs) car une hauteur de tonte plus élevée implique une rétention d’humidité foliaire également plus élevée. Une première étude menée dans le Nord Est des USA a montré que l’intensité des attaques était plus élevée pour des hauteurs de tonte de 8,9 cm par rapport à 1.27 cm69. Dans le Kentucky, une autre étude ne trouve aucune différence dans l’intensité des attaques pour du raygrass anglais tondu à 1,9 cm ou 6,4 cm70. Différents paramètres culturaux et climatiques peuvent cependant expliquer les différences entre les deux études. Toutefois, il est conseillé aux intendants de ne pas relever la hauteur de tonte lors des périodes propices au développement du champignon pathogène dans le des USA33, malgré une photosynthèse plus importante.
Concernant les déchets de tonte, il a été montré que lors d’attaques de faible intensité de P. oryzae, l’extraction des déchets de tonte diminue l’incidence de la maladie. Lors d’attaques plus sévères, l’extraction n’a par contre aucun effet sur l’incidence de la maladie69,71.
A titre personnel, je recommande de ne pas remonter la hauteur de tonte dans les stades lors de la période estivale et de rester au maximum à 25 mm pour limiter l’humectation foliaire et faciliter le séchage des feuilles.
Fertilisation
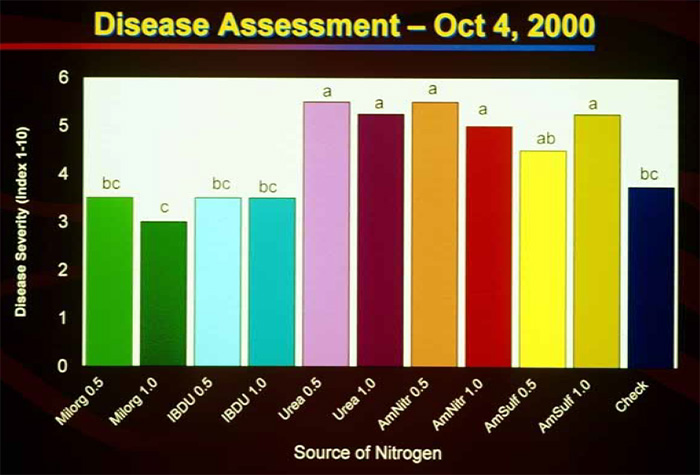
Des fertilisation azotées trop élevées augmentent l’intensité des attaques de P. Oryzae69,70,72. Une de ces publications démontre notamment que la source d’azote utilisée influence le développement du champignon pathogène sur raygrass anglais et fétuque élevée72. L’intensité des attaques est moindre lorsque des engrais à libération lente étaient utilisés (IBDU et engrais à base de boue d’épuration Milorganite) par rapport aux sources d’azote à libération rapide comme les nitrates ou l’urée. Il est probable que d’autres formes d’azote à libération lente soient également efficaces, elles sont nombreuses : urée formaldéhyde, méthylène urée ou engrais enrobés.
Un des spécialistes de la maladie, B. Clarke, recommande de ne pas appliquer d’azote lors de la période estivale. Toutefois, si des applications doivent être réalisées, de l’azote à libération lente devrait être préféré avec des quantités d’azote comprises entre 5 et 12 kg/ha73. En ce sens, des apports d’engrais foliaires à base de méthylène urée sont une excellente idée. Pour finir, il convient d’éviter les engrais acidifiants, du fait d’une intensité plus importante de la maladie pour des pHs inférieurs à 6,573. Le sulfate d’ammonium et les engrais à forte teneur en soufre (teneur visible sous la forme de SO3 sur les étiquettes) par exemple sont à éviter si possible.
Sur les stades de haut niveau équipés de terrains renforcés composés intégralement de sable, les contraintes du calendrier imposent une rénovation en 8 à 10 semaines ce qui représente un challenge pour les gestionnaires des pelouses. Dans ce cas, il est impossible de limiter les applications d’azote sans quoi le terrain n’est pas praticable à la reprise du championnat. La faible capacité d’échange cationique et le fort pouvoir filtrant de ces terrains associés à un calendrier défavorable impliquent des fertilisations rapprochées avec des quantités non négligeables les deux premiers mois d’installation. Ces rénovations estivales ont malheureusement lieu lors du pic de développement de P. oryzae.
Ainsi, sur les pelouses non rénovées avec un gazon mature (deuxième saison), les fertilisations solides devraient être limitée au strict minimum pour garantir une pousse acceptable et une couverture optimale (une fois par mois si c’est possible avec des passages d’engrais à fort pourcentage d’azote à libération lente autour de 30 kg N/ha par application). Les fertilisation foliaires azotées peuvent être une solution dans ce cas (7 à 10 kg N/ha suffisent par passage) avec une application toutes les 7-12 jours. Une combinaison des deux types de fertilisation est également envisageable. La mesure des volumes de tonte peut être un outil dans l’ajustement fin de la fréquence et des quantités à apporter.
Pour les pelouses rénovées, c’est un véritable casse-tête car il n’est pas rare d’appliquer 30-40 kg d’azote/ha tous les 10 jours lors de l’installation, le gazon nécessitant des apports d’eau réguliers pour finir de déclencher la germination des graines les plus lentes et pour subvenir aux besoins en eau des jeunes plantules. Évidemment une quantité non négligeable d’engrais est lessivée dans ces inévitables conditions, ce qui explique une fréquence élevée. La fertilisation liquide est envisageable mais n’est absolument pas suffisante pour respecter les délais. Dans ce cas, pas de méthode miracle et c’est souvent une longue partie de poker plus qu’un parcours méthodique et maîtrisé. L’utilisation d’engrais à libération rapide qui permet parfois de gagner du temps est toutefois une mauvaise idée car à l’origine de nombreux départs de pyriculariose : il faudra préférer des formulations à forte teneur en azote à libération lente (méthylène urée, IBDU ou engrais enrobés). Ces dernières ne garantissent toutefois pas l’absence de développement de la maladie !
Bénéfices de la silice sur le développement de P. oryzae
La silice est connue depuis de nombreuses années pour réduire l’incidence et l’intensité des maladies du sol et foliaires74. Les effets favorables de la silice pour contrôler les maladies fongiques des monocotylédones, principalement le riz et d’autres graminées sont documentés depuis les années 6075. Pour le riz, la silice s’accumule au niveau de la cuticule pour former une double couche. Cette couche est connue pour prévenir physiquement la pénétration des champignons pathogènes mais également pour rendre moins vulnérable la cuticule aux dégradations enzymatiques des champignons pathogènes76. La silice ne crée pas seulement une barrière mécanique contre les pathogènes mais induirait également une résistance chez la plante hôte77,78. Le tableau 1 répertorie les études menées sur gazon en ce qui concerne les bénéfices de la silice contre P. oryzae.
| Espèce | Type de silice | Conditions essais | Dosage | Teneur en silice dans les tissus foliaires | Effet de la silice | Référence |
|---|---|---|---|---|---|---|
| Saint Augustine Grass | Scories de silicate de calcium (solide) Wollastonite (solide) |
microparcelles | 1T/ha | 1,2 à 1,3% avec apport 0,6 à 0,7% sans apport |
Réduction de la progression de la maladie de 7 à 41% suivant le site avec un cas significatif | (Brech et al., 2004) |
| Raygrass anglais | Scories de silicate de calcium (solide) Wollastonite (solide) |
Sous serre et sur microparcelles |
0 à 10T/ha 0 à 12T/ha |
0,5% à 2,5% suivant le type de silice et la quantité | Réduction de la maladie jusqu’à 71% par rapport au témoin | (Nanayakkara et al., 2008) |
| Raygrass anglais | Silicate de calcium (solide) | Sous serre | 1 à 10T/ha | ? | Réduction significative de la maladie à 1 et 5T/ha. Optimal à 5T/ha. Amélioration des réactions de défense de la plante aux attaques de GLS |
(Rahman et al., 2015) |
| Raygrass anglais Raygrass italien |
Silicate de potassium (liquide) – Ksil® | Sous serre | 50 à 300 ppm 1 à 2 fois par semaine |
? | 17 à 23% de réduction de la maladie par rapport au témoin sur raygrass anglais 27 à 29% de réduction de la maladie par rapport au témoin sur raygrass italien |
(Dammie, 2017) |
| Raygrass anglais Raygrass italien |
Silicate de potassium (liquide) – Ksil® | microparcelles | 200 et 300ppm 1 fois par semaine |
? | Résultats non significatifs sur microparcelles | (Dammie, 2017) |
Tableau 1 : Liste des études menées sur gazon en ce qui concerne les bénéfices de la silice sur la pyriculariose du gazon.
La plupart des études utilisent des scories de silicate de calcium qui augmentent significativement la teneur en silice des tissus foliaires74,78,79. Dans ces essais conduits sous serre ou sur microparcelles, l’application de 1 à 10T/ha de silicate de calcium permet de réduire significativement le développement de P. oryzae par rapport au témoin. L’efficacité est tout de même plus faible que celle observée avec l’azoxystrobine, fongicide réputé pour être très efficace sur le champignon pathogène. Plus récemment80, N. Dammie a étudié pour son stage de fin d’études de Master l’effet du silicate de potassium liquide dans la lutte contre P. oryzae. Appliqué au niveau racinaire, le silicate de potassium réduit significativement le développement du pathogène sous serre mais pas en conditions réelles sur microparcelles. D’autres études seraient nécessaires pour mieux connaître l’efficacité de la silice par voie liquide et notamment par voie foliaire car la plupart des spécialités commerciales disponibles sur le marché à l’heure actuelle se retrouvent sous cette forme.
Irrigation
Comme évoqué précédemment, puisque le développement de la maladie est fortement dépendant de la température et de l’humidité (durée d’humectation du feuillage) il apparait assez évident que la meilleure solution consiste à arroser abondamment avec une faible fréquence. Cette fréquence ne doit toutefois par être trop faible car elle peut engendrer un stress supplémentaire (hydrique) pour les espèces sensibles et devenir un facteur de développement de la maladie. Lors de la période estivale, les arrosages devraient être effectués en fin de nuit ou en pleine journée afin de réduire au maximum la durée d’humectation des feuilles. Évidemment, dans le contexte actuel de raréfaction de la ressource en eau, les arrosages en pleine journée sont peu recommandables car l’évaporation est dans ce cas élevée et une partie non négligeable de l’eau apportée n’est alors pas utilisée par la plante.
Lorsque la température est trop élevée, des syringes sont couramment effectués en journée afin de rafraîchir les plantes. Il est entendu par « syringe » 1 à 2 tours d’arroseurs. Concernant P. Oryzae, l’alternance de phases sèches et humides favoriserait son apparition. Les syringes pourraient donc être un facteur aggravant114. Des travaux sur ce sujet permettraient d’éclairer les intendants sur la question.
A l’heure actuelle, seule deux publications étudient l’incidence des pratiques d’arrosage sur P. Oryzae108,114.
Dans une première expérimentation menée sur deux saisons, les auteurs étudient l’impact de deux types d’arrosages :
- Arrosages peu fréquents mais avec une lame d’eau élevée effectués tôt le matin. La pelouse est arrosée dès les premiers signes de sécheresse ou lorsque l’humidité descend en dessous de 17% (capacité au champ).
- Arrosages fréquents (journaliers) avec des quantités d’eau inférieures par arrosage (en moyenne 5 mm d’eau).
La première saison est marquée par des périodes prolongées de chaleur et sécheresse (2002). Entre 25 et 38 mm d’eau sont arrosés par semaine pour les deux types d’irrigation. La seconde saison (2004), 64 mm sont appliqués dans le cas d’arrosages intenses mais peu fréquents et 21 mm dans le cas d’arrosages journaliers. En 2002, le type d’arrosage n’a pas d’impact sur l’incidence ou l’intensité de P. Oryzae. En 2004, l’intensité du pathogène est plus élevée dans le cas d’arrosages journaliers. Les auteurs concluent également qu’en cas de forte pression et sans utilisation de fongicide, l’humidité du sol ne semble pas avoir d’impact sur l’intensité de la maladie108. Dans le cas d’utilisation de fongicide (chlorothalonil dans l’étude), les arrosages moins fréquents permettent une meilleure efficacité du produit108. Si la pression plus faible, des arrosages moins fréquents sembleraient moins propices au développement du pathogène, ce qui rejoint la remarque intuitive évoquée plus haut.
Un second travail plus intéressant réalisé à l’université de Pennsylvanie dans le cadre d’une thèse de doctorat étudie l’effet de l’intermittence de phases sèches et humides (durée, fréquence) et leur effet sur le développement de la pyriculariose sur une variété sensible de raygrass anglais114.
L’étude montre qu’il existe une relation linéaire entre la fréquence/durée des périodes sèches et la réduction de l’intensité/sévérité de la maladie. L’effet de la fréquence est plus marqué sur le développement de la maladie que celui de la durée. En augmentant la fréquence des périodes sèches, l’intensité et la sévérité peuvent être réduits de 50 à 60%. De plus, pour des périodes humides de même durée, la durée des périodes sèches diminue significativement les symptômes de la maladie.
En termes pratiques, rien de nouveau : ces résultats confirment l’intuition :
- les arrosages doivent être les moins fréquents et les moins longs possibles (certains systèmes d’arrosages sont limitants sur ce dernier point dans leur configuration)
- les périodes où le gazon est sec doivent être les plus longs et les plus fréquents possibles
- L’utilisation de toutes les méthodes qui limitent l’humectation foliaire sont par conséquent utiles préventivement : faire tomber l’humidité (le matin après la rosée ou après une pluie), séchage du brin avec un flux d’air permis par des ventilateurs en nombre suffisant, arrosage le matin pour un retour vers une situation sèche le plus rapidement possible
Enfin, l’utilisation de sondes d’humidité est fortement conseillée en période estivale pour vérifier la bonne humidité du sol et éviter les « coups de chaud » ou les humidités trop élevées propices au développement de différents pathogènes.
A titre personnel, je pense que la maladie se développe sur un gazon stressé. Ainsi, la maladie se développe fortement souvent après un ou plusieurs « déclencheurs » : température trop élevée pour les espèces sensibles (>28°C) couplée à un stress hydrique. Ainsi, malgré des pluies ou des périodes prolongées d’humidité, rien ne se passe parfois pendant un laps de temps. Il suffit alors d’une semaine avec des températures supérieures à 30°C et une méthode d’arrosage trop stressante (arrosages abondants et trop peu fréquents) pour affaiblir le gazon qui devient alors plus sensible au pathogène. En effet, la maladie se propage en général depuis les zones les plus exposées au soleil (demande évapotranspiratoire plus élevée) ce qui va dans le sens de cette hypothèse. De plus, les premières épidémies de pyriculariose sont apparues en France avec l’arrivée des surfaces hybrides lors de la période de l’Euro en 2016. Hors, ces substrat composés quasi intégralement de sable sont des supports stressants lors de la période estivale (chauffent très vite car conduisent très bien la chaleur et sèchent très rapidement) ce qui est favorable au développement de la pyriculariose. Les supports plus naturels (terre/sable ou terre) sont mieux tamponnés en ce qui concerne la gestion de l’eau ce qui les rend moins favorables au développement du pathogène. C’est probablement pour cette raison que la pyriculariose est peu visible dans les terrains communaux composés majoritairement de terrains en terre/sable ou terrains naturels.
Ainsi, pour gérer au mieux l’irrigation, il convient d’adopter :
- une méthode d’irrigation la plus équilibrée possible, ni trop, ni pas assez en volume, ni trop , ni pas assez en fréquence. La manière précise de fonctionner dépend vraiment du site et du climat et nécessiterait un article à elle seule.
- privilégier un arrosage quotidien lorsque c’est possible qui complète le stock du sol avec une marge suffisante en dessous de la capacité au champ (sur les sables filtrants entre 16 et 22% d’humidité représentent des valeurs raisonnables après un arrosage). Si aucune sonde d’humidité n’est disponible, se baser sur 60-80% de l’évapotranspiration potentielle (ETp) est une bonne base pour démarrer. Dans ce cas, vérifier si le volume correspondant est bien disponible pour le système racinaire en un seul arrosage. Fractionner en 2 arrosages si ce volume est trop élevé. En effet, des systèmes racinaires très peu développés ont accès à une volume de sol très faible (ce qui représente en équivalent lame d’eau seulement quelques millimètres).
- lorsque les substrats sont trop séchants et l’enracinement limité, limiter quand même au maximum le nombre d’arrosages avec un premier effectué le matin et l’autre en milieu d’après midi. Les mesures avec les sondes permettent de mieux cerner la dynamique de gain et de perte d’humidité lors des journées chaudes et d’ajuster la fréquence et la quantité.
- bannir les arrosages nocturnes qui laissent le gazon mouillé pendant de trop nombreuses heures.
- limiter au maximum les arrosages sur des zones à l’ombre qui ne vont pas sécher avant de nombreuses heures ou avant le lendemain (trop tôt le matin ou trop tard dans l’après-midi). Il suffit de quelques heures d’humectation lorsque les températures sont favorables pour permettre la germination des spores.
Le choix de cultivars résistants
A ce jour, Pyricularia oryzae touche le raygrass anglais, le raygrass annuel et la fétuque élevée pour ce qui concerne les espèces utilisées sur les stades. Le pâturin des prés et les pâturins en général sont résistants et ne sont pas touchés par la maladie. La suite de cet article concerne principalement le raygrass anglais et sa sélection pour la résistance à P. oryzae.
La résistance d’un cultivar à une souche pathogène peut être de deux type : totale ou partielle. En règle générale, un gène majeur implique une résistance souvent totale ou résistance qualitative (absence ou présence de développement du champignon pathogène) alors que différents gènes mineurs impliquent une résistance partielle ou résistance quantitative (le champignon se développe avec une faible incidence). La résistance partielle est en générale plus durable puisque différents gènes sont impliqués dans la résistance et il est alors plus difficile pour les souches pathogènes de s’adapter. Dans le cas d’une résistance totale, un gène majeur est souvent à l’origine de cette résistance et les mutations s’effectuant chez le champignon peuvent contourner ce gène pour trouver un nouveau moyen de se développer à nouveau81.
Chez le riz, différents gènes majeurs impliqués dans une résistance totale à P. oryzae ont été identifiés mais également de nombreux gènes mineurs octroyant une résistance partielle81. Jusqu’en 2004, plusieurs années après les premières grosses épidémies de P. oryzae, très peu de caractères de résistance ont été signalés dans la multitude de variétés de raygrass anglais existants70,82 (voir les variétés sensibles sur les figures 16 et 17). Seuls quelques matériels génétiques américains ou importés d’Europe de l’Est montraient certains degrés de résistance82,83. Les chercheurs ont donc d’abord tenté d’identifier les marqueurs moléculaires associés à la résistance au P. oryzae dans une population sélectionnée81,81,84,85. Une résistance partielle au pathogène a été identifiée86. Les plantes résistantes montrent par rapport à des sujets sensibles des plus petites lésions et un degré de reproduction plus faible du pathogène. L’intensité des attaques est variable suivant l’âge de la plante (plus virulent sur jeunes plantules), la fertilisation en azote, à l’intensité de la lumière mais également à la température et au type de sol84.

Ainsi, depuis 2004, différents travaux de recherches et de sélection ont permis d’obtenir des variétés résistantes partiellement au P. oryzae. Les essais officiels américains (NTEP pour National Turfgrass Evaluation Program) évaluent chaque année depuis les essais de 1999 la résistance au champignon pathogène (Lien vers les notes NTEP pour 1999). Il est d’ailleurs possible de constater clairement l’amélioration génétique de ce critère puisque la plupart des cultivars obtenaient une note entre 5 et 6 alors que désormais, cette même moyenne se situe entre 7 et 8 (Lien vers les notes NTEP pour 2010). Une très nette amélioration est d’ailleurs visible depuis les essais de 2004, période à laquelle de nombreux efforts de sélection ont été réalisés (Lien vers les notes du NTEP pour 2004). De nombreux cultivars américains possèdent donc désormais une résistance partielle au pathogène. Ces cultivars ne garantissent pas l’absence total de symptômes comme évoqué précédemment mais une intensité et une incidence très faibles comparé à des cultivars sensibles.
En 2019 et 2020, j’ai pu toutefois constater sur les stades de Ligue 1 et Ligue 2 que la plupart des mélanges de raygrass anglais composés de variétés dites « résistantes » le développement parfois important du pathogène. Des essais que j’ai pu faire avec avec Natural Grass en conditions contrôlées ont pu montrer que la résistance de certaines variétés dépendaient du support dans lequel elles étaient installées. Différentes questions se posent alors : soit la génétique des souches européennes est différentes des américaines avec des gènes de résistances peu efficaces avec les souches européennes, soit les supports rencontrés dans les stades de haut-niveau ne permettent pas à ces gènes de résistance de s’exprimer. Une meilleure caractérisation des souches de P. oryzae européennes permettrait de répondre à ces questions.
Sur le marché français, plusieurs de ces cultivars sont disponibles auprès de différents fournisseurs. Le tableau 3 inclue une liste non exhaustive de différentes variétés résistantes à P. oryzae mais également quelques exemples de variétés récentes sensibles, disponibles sur le marché Français. Toutes les variétés listées ont été inscrites aux essais officiels américains et ont donc été notées sur leur résistance à P. oryzae sur différentes stations aux conditions climatiques contrastées aux USA pendant 4 ans. A noter cependant que lors du choix d’une variété, il est important de ne pas seulement se focaliser sur un critère mais sur un ensemble de critères qui correspondent aux conditions pédoclimatiques et contraintes du lieu et du type d’utilisation.
A noter que j’ai écrit un article spécifique et plus poussé sur la résistance variétale des gazons à la pyriculariose avec une liste des variétés les plus résistantes suivant les essais effectués aux USA. L’article est disponible en cliquant ici.
| Variété | Nom américain | Distributeur | Année d’inscription en Europe | NTEP | Note GLS NTEP | Lien NTEP |
|---|---|---|---|---|---|---|
| Fiesta 4 | Fiesta 4 | Fito | 2012 | 2005-2009 | 9 | Lien NTEP |
| Rinovo | Rinovo | Fito | 2012 | 2011-2014 | 8,3 | Lien NTEP |
| 1G squared | 1G squared | Teamgreen | 2012 | 2005-2009 | 8,6 | Lien NTEP |
| Galleon | SR4600 | Teamgreen/Souffle Vert/DLF | 2012 | 2005-2009 | 8,9 | Lien NTEP |
| Homerun | Homerun | Teamgreen | 2014 | 2005-2009 | 7,8 | Lien NTEP |
| Silverdollar | Silverdollar | ICL/Fito | 2007 | 2005-2009 | 7,7 | Lien NTEP |
| Apple SGL | Apple SGL | ICL? | 2018 | 2011-2014 | 8,7 | Lien NTEP |
| Equate | Caddieshack II | ICL | 2008 | 2005-2009 | 5,9 | Lien NTEP |
| Fastball RGL | Fastball RGL | ICL | 2016 | 2011-2014 | 8 | Lien NTEP |
| Grandslam GLD | Grandslam GLD | ICL | 2016 | 2011-2014 | 8,3 | Lien NTEP |
| All Starter | Allstar 3 | Teamgreen/? | 2012 | 2005-2009 | 8,9 | Lien NTEP |
| Dasher 3 | Dasher 3 | Topgreen/DLF? | 2015 | 2005-2009 | 8,9 | Lien NTEP |
| Banfield | Banfield | DLF | 2016 | 2011-2014 | 8 | Lien NTEP |
| Bandalore | Bandalore | DLF | 2016 | 2011-2014 | 8 | Lien NTEP |
| Totilas | Soprano | Freudeunberger | 2012 | 2005-2009 | 8,9 | Lien NTEP |
| Pizzazz 2 | Pizzazz 2 | Inscription par TMI/Distributeur? | 2015 | 2011-2014 | 8,3 | Lien NTEP |
| Aspire | Aspire | Souffle Vert/DLF | 2016 | 2005-2009 | 8,7 | Lien NTEP |
| Excite | Revenge GLX | Teamgreen/Jacklin Seed | 2007 | 2005-2009 | 8,5 | Lien NTEP |
| Harrier | Harrier | DLF | 2012 | 2005-2009 | 8,4 | Lien NTEP |
| Paragon GLR | Paragon GLR | Inscription par TMI/Distributeur? | 2013 | 2005-2009 | 8,5 | Lien NTEP |
| Panther GLS | Panther GLS | Inscription par Proseeds/Distributeur? | 2009 | 2005-2009 | 8,1 | Lien NTEP |
| Confidence | Allante | Teamgreen/? | 2015 | 2011-2014 | 5,3 | Lien NTEP |
| New Orleans | Sienna | Souffle Vert/? | 2011 | 2011-2014 | 3,7 | Lien NTEP |
Tableau 3 : liste non exhaustive de différentes variétés résistantes à P. Oryzae mais également quelques exemples de variétés récentes sensibles (les deux dernières sont d’ailleurs stolonifères et sont sensibles à la pyriculariose).

Suite aux nombreuses épidémies aux USA à la fin des années 90 et début des années 2000, de nombreux golfs ont choisis de changer totalement d’espèces en passant de fairways en 100% raygrass anglais à des fairways en pâturin des prés ou agrostides, beaucoup moins sensibles à P. oryzae33,87,88. Cette méthode est éventuellement envisageable dans les golfs sur fairways malgré un coût prohibitif des semences d’agrostides et pâturin des prés. La maintenance nécessaire est également bien plus complexe dans le cas de l’agrostide ainsi qu’un déplacement du problème de P. oryzae vers le problème du Dollar Spot. Sur les stades, la question ne se pose pas puisque la fétuque élevée et le raygrass anglais sont utilisés principalement sous nos latitudes éventuellement en mélange avec du pâturin des prés.
Outre les variétés de raygrass anglais partiellement résistantes, le mélange classique avec 50% de pâturin des prés peu sensible est une solution envisageable. La fétuque élevée, un peu moins sensible à P. oryzae peut être également une solution potentielle dans les zones Sud de la France, en mélange avec des variétés résistantes de raygrass anglais. Elle s’adapte également jusqu’à la région parisienne mais l’aspect hivernal reste un peu médiocre lorsqu’elle n’est pas en mélange.
En raison de la forte sensibilité du raygrass anglais à P. oryzae la première année, il est déconseillé de regarnir un terrain touché par la maladie lors de la période estivale. Si toutefois la densité perdue est trop importante,les regarnissages doivent être effectués avec des variétés de raygrass anglais résistantes. Un traitement préventif est alors indispensable (fongicide de synthèse ou à minima un biocontrôle).
Le pâturin des prés : une espèce résistante à la maladie
Enfin, une dernière option repose sur l’utilisation à 100% du pâturin des prés, ce dernier n’étant pas touché par la maladie. Cette option est toutefois contraignante car elle nécessite beaucoup plus de temps pour disposer d’un terrain apte au jeu (le pâturin des prés s’installe lentement). Elle dépend également fortement des conditions météorologiques. De plus, les regarnissages réguliers en raygrass anglais lors de la saison froide nécessiteront un scalpage intégral de la pelouse si la méthode doit être renouvelée l’été suivant sans quoi le raygrass anglais semé l’hiver aura un potentiel à être touché par la maladie. Noter que dans ce cas, le raygrass anglais est moins sensible en deuxième année de culture : les dégâts devraient être plus modérés.
L’option est possible pour certains stades qui peuvent se permettre des placages lors de la période estivale : il est alors nécessaire de demander à la gazonnière de mettre en culture un placage constitué à 100% de pâturin des prés.
Elle est aussi envisageable dans le cas de terrains d’entraînements où la fenêtre d’indisponibilité du terrain peut être plus large que les 8 à 10 semaines usuelles.
Elle est relativement inadaptée aux cas classiques de rénovation estivale de stades où 8 semaines seulement sont disponibles pour remettre en jeu le terrain : le risque de ne pas avoir un terrain prêt pour le jeu est trop élevé.
Ce qu’il faut retenir
- A l’heure actuelle, la méthode préventive qui donne les meilleurs résultats réside dans le choix de d’espèces ou cultivars résistants. Différents cultivars existent, se référer au tableau 3.
- Éviter au maximum les regarnissages avec du raygrass anglais ou de la fétuque élevée lors de la période estivale car ces espèces sont très sensibles la première année d’installation
- Le pâturin des prés est une espèce résistante à privilégier mais elle nécessite un temps d’installation souvent incompatible avec les calendriers d’utilisation des terrains
- Des hauteurs de tontes plus élevées impliquent une humectation du feuillage plus importante et un risque plus élevé de développement du pathogène
- Sur gazon mature, limiter les fertilisation estivales au maximum et privilégier de faibles apports d’azote par voie foliaire tous les 7-10 jours (5 à 12 kg N/ha). Si l’application d’engrais solide est la seule possible, utiliser des engrais à forte teneur en azote à libération lente en limitant les apports à 30 kg N/ha et par mois. Dans le cas de rénovations complètes avec scalpage et semis : pas le choix sur les quantités et la fréquence. Restons honnête c’est un jeu de poker où certains gagnent et d’autres perdent.
- Les produits à base de silice semblent donner de bons résultats en prévention de la maladie.
- Les arrosages doivent être effectués tôt le matin pour limiter la durée d’humectation foliaire. Bannir les arrosages des zones à l’ombre en fin d’après midi ou les arrosages nocturnes. La gestion de l’arrosage est un point clé concernant le développement du pathogène.
- Pour les stades, des ventilateurs existent afin de limiter l’humidité foliaire : pas de miracle, ces derniers doivent être combinés avec l’ensemble des solutions disponibles.
Biocontrôle
En France, seules les spécialités Harmonix Turf Defense (souche de Bacillus subtilis QST713) et Tri-Lawn® (souche de Trichoderma atroviride I1237) sont homologuées en tant que fongicide de biocontrôle avec un usage spécifique « Pyriculariose« . Les résultats d’études ci-dessous sont données à titre informatif.
Des efforts considérables ont été mis en œuvre dans le développement de solutions de biocontrôle ces dernières années. Parmi les stratégies de lutte, il existe probablement de nombreux microorganismes dont les effets sur P. Oryzae sont encore peu ou pas documentés (certains champignons ou bactéries antagonistes). En France, aucun produit homologué de biocontrôle ne possède d’usage pour ce pathogène sur gazon.
Une publication a étudié les effets de la bactérie Pseudomonas aeruginosa (voir figure 19) isolée d’un compost de production de champignon ayant un effet hautement antagoniste sur M. oryzae106. Dans des conditions contrôlées, les souches de bactéries étaient aussi efficaces que le propiconazole mais significativement moins que l’azoxystrobine. Au champ, l’application préventive de Pseudomonas aeruginosa permet le contrôle du pathogène jusqu’à 14 jours106. Une autre bactérie, Bacillus lentimorbus isolée de la rhizosphère du raygrass anglais est également antagoniste de M. oryzae107. Sur boîte de Pétri, la bactérie inhibe le développement mycélien de souches du pathogène isolées sur raygrass anglais, fétuque élevée et riz. Sous serre, la bactérie appliquée préventivement diminue significativement l’intensité et l’incidence de la maladie jusqu’à 20 jours107.
Plus récemment, un étudiant de master a étudié l’efficacité sous serre et au champ de différentes préparations microbiennes et fongiques sur P. oryzae80. L’étude prend le soin de d’isoler 87 différentes bactéries et champignons déjà connues pour leur efficacité sur P. oryzae sur riz. Elle inclue également deux spécialités commerciales à base de Trichoderma Harzianum.
La première partie étudie l’antagonisme in-vitro (sur boîtes de Pétri) des différentes souches sur P. oryzae. Seules 18 souches isolées sur les 87 possèdent un pouvoir antagoniste avec une inhibition de P. oryzae variant de 63,5 à 85%. 9 souches bactériennes sont sélectionnées pour la deuxième partie de l’étude, elles comprennent des Bacillus (amyloliquefaciens et cereus) et Pseudomonas. L’étude retient également des souches de Trichoderma Harzianum (T77 et KD) pour leur forte inhibition in-vitro (environ 80%, voir figure 20).
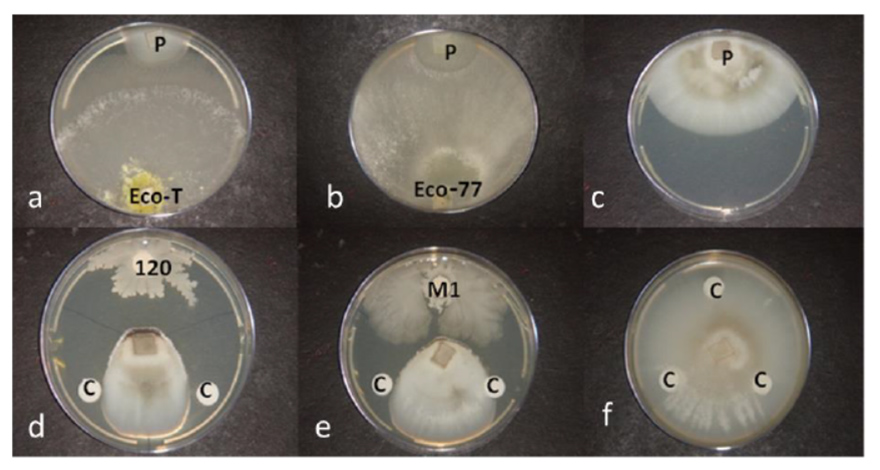
La seconde partie est effectuée sous serre et sur raygrass (annuel et anglais)80. Les résultats sont contrastés. Sans surprise, l’azoxystrobine est le traitement le plus significativement efficace (35 et 54% d’efficacité dans les essais 1 et 2). Certaines souches de Bacillus sp., B. amyloliquefaciens et Pseudomonas montrent une certaine efficacité mais non significative. Une seule préparation bactérienne à base de Bacillus Cereus permet de réduire significativement le développement de P. Oryzae (35 et 45% d’efficacité dans les essais 1 et 2). Les deux souches de Trichoderma Harzianum testées n’ont pas permis de réduire significativement le développement du pathogène.
Enfin, la dernière partie étudie l’effet sur microparcelles de souches bactériennes et de Trichoderma Harzianum. Au champ, une des deux souches de Bacillus (Bacillus sp.) ayant fait ses preuves sous serre permet de réduire significativement le développement de P. Oryzae par rapport au témoin. La seconde souche (B. Cereus) diminue l’intensité de P. Oryzae mais pas le résultat n’est pas statistiquement significatif.
Au final, cette étude complète est largement encourageante par rapport à l’utilisation de souches bactériennes ou fongiques sur des maladies du gazon comme P. oryzae. D’autres investigations seraient nécessaires pour mieux cerner les souches potentielles et le cadre de leur utilisation. L’utilisation conjointe de ces produits préventifs avec des variétés résistantes permettrait peut-être de limiter suffisamment le développement d’épidémies. Dans le cas de maladies largement déclarées, le recours aux fongicides de synthèse reste malheureusement l’unique solution efficace.
Paroles d’experts scientifiques
PETER LANDSCHOOT
Peter Landschoot est professeur et chercheur en sciences du gazon à l’université de Penn State (Pennsylvanie).
Il est également directeur des formations supérieures universitaires spécialisées en gazon au sein de l’université. Il a publié de nombreux travaux sur les pathologies et la gestion du gazon (voir sa page web) et anime régulièrement de nombreux séminaires et conférences.
Ayant travaillé notamment sur Gray Leaf Spot, il a accepté de répondre à mes questions concernant ce pathogène à l’origine de nombreuses épidémies au début des années 2000 aux Etats-Unis.
R. Giraud : Que pensez-vous des origines du champignon pathogène?
P. Landschoot : Pyricularia oryzae trouve probablement ses origines dans la production agricole de riz et peut-être d’autres cultures céréalières en Europe et en Afrique. Les spores peuvent se propager par le biais du vent. Je ne pense pas que le pathogène en Europe proviennent des semences de raygrass anglais importées des Etats-Unis mais je ne peux pas être sûr de ce propos.
R. Giraud : Quelle est selon vous la meilleure manière de gérer le pathogène sur les stades, golfs?
P. Landschoot : La meilleure manière est d’essayer d’implanter des cultivars résistants s’il sont disponibles en Europe : c’est le meilleur moyen de contrôler la maladie. Il faut également faciliter les flux d’air ou utiliser les tondeuses ou dragmats pour retirer l’humidité de la surface foliaire le matin. Cette pratique permettra de réduire la durée d’humectation de la surface foliaire et réduira donc la germination des spores et par conséquent l’infection du champignon pathogène. La sur-stimulation de la croissance foliaire avec des fertilisation azotées trop élevées favorise également le développement de Gray Leaf Spot. Par conséquent, il faut veiller à ne pas appliquer trop d’azote lors des périodes à risque. Si l’été est chaud et humide, alors une application de fongicide est quasiment obligatoire. J’ai cru comprendre que l’utilisation des fongicides était restreinte en Europe mais une pulvérisation au bon moment peut sauver la surface engazonnée avant que l’attaque de Gray Leaf Spot devienne trop intense.
R. Giraud : Quelles conditions (climat, type de sols, …) sont propices au développement de Gray Leaf Spot?
P. Landschoot : Les températures élevées (28 à 35°C) combinées à des durées prolongées d’humectation de la surface foliaire (24 à 48 heures) constituent les conditions optimales de développement du pathogène. Une fertilisation azotée trop élevée augmente également le risque de développement du pathogène. Enfin, les jeunes gazons sont plus sensibles que les gazons à maturité.
BRUCE CLARKE
Bruce Clarke est professeur et chercheur en sciences du gazon à l’université de Rutgers (New Jersey).
Spécialiste des maladies du gazon, il a participé à de nombreux travaux de recherche sur Gray Leaf Spot et a également publié de nombreux articles sur le champignon pathogène.
Il a également accepté de donner son avis sur la maladie.
R. Giraud : Quelles conditions sont propices au développement de Gray Leaf Spot?
B. Clarke : Gray Leaf Spot est devenu un problème aux Etats-Unis depuis la fin des années 80. C’est une pathologie qui concerne principalement les gazons regarnis car les jeunes plantules sont fortement susceptibles à la maladie 4 à 5 semaines après germination. Les plants matures sont bien moins sensibles au Gray Leaf Spot. La maladie est la plus virulente lorsque la température nocturne se situe au-delà de 17°C et quand le gazon est sur-fertilisé en azote.
R. Giraud : Quelles sont les solutions les plus efficaces?
B. Clarke : Le moyen le plus efficace dans le contrôle de la maladie est l’implantation de cultivars résistants. Il est également fortement recommandé de décaler les regarnissages ou overseedings jusqu’à des périodes plus douces en automne (mi-Septembre dans l’Est des Etats-Unis).
R. Giraud : Sur quels aspects avez vous travaillé concernant Gray Leaf Spot?
B. Clarke : Mes travaux de recherche concernant la maladie se concentraient principalement sur la lutte chimique (voir le guide des fongicides que j’ai rédigé avec Paul Vincelli en 2017). A l’heure actuelle, peu de travaux concernent ce champignon pathogène puisque les golfs utilisent désormais des variétés résistantes ou des espèces différentes (pâturin des prés, agrostides).
Bibliographie
- Hernot, M. (2018). Pourquoi les pelouses de Ligue 1 sont si pourries. Ouest France https://www.ouest-france.fr/leditiondusoir/data/31431
- Borella, J. C. (2018). Les gazons maudits de la Ligue 1. Le Monde
- Loury, R. (2018). Le blé européen menacé par le football? Journal de l’environnement 1 p. http://www.journaldelenvironnement.net/article/le-ble-europeen-menace-par-le-football
- Gazon Sport Pro H24. (2018). Gazon impraticable pour le FC Lorient : que s’est-il passé au Moustoir ? Gazon Sport Pro H24 Article web, http://www.gsph24.com/articles/gazon-impraticable-fc-lorient-moustoir-pyriculariose
- Article. (2018). Le Football menacerait-il les cultures de blé européennes ? European Scientist https://www.europeanscientist.com/fr/agriculture-fr/le-football-menacerait-il-les-cultures-de-ble-europeennes/
- Couch, B. C. & Kohn, L. M. (2002). A multilocus gene genealogy concordant with host preference indicates segregation of a new species, Magnaporthe oryzae, from M. grisea. Mycologia 94, 683–693
- Kato, H. et al. (2000). Pathogenicity, Mating Ability and DNA Restriction Fragment Length Polymorphisms of Pyricularia Populations Isolated from Gramineae, Bambusideae and Zingiberaceae Plants. J Gen Plant Pathol 66, 30–47 https://doi.org/10.1007/PL00012919
- Rossman, A. Y., Howard, R. J. & Valent, B. (1990). Pyricularia grisea, the Correct Name for the Rice Blast Disease Fungus. Mycologia 82, 509–512 https://doi.org/10.2307/3760024
- Couch, B. C. et al. (2005). Origins of host-specific populations of the blast pathogen Magnaporthe oryzae in crop domestication with subsequent expansion of pandemic clones on rice and weeds of rice. Genetics 170, 613–630 https://doi.org/10.1534/genetics.105.041780
- Zeigler, R. S. (1998). Recombination in Magnaporthe grisea. Annu Rev Phytopathol 36, 249–275 https://doi.org/10.1146/annurev.phyto.36.1.249
- Bain, D. C., Patel, B. M. & Patel, M. V. (1972). Blast of ryegrass in Mississippi. Plant Disease Report 56, 210
- Pappas, A. C. & Paplomatas, E. J. (1998). Pyricularia Leaf Spot: A New Disease of Ornamental Plants of the Family Marantaceae. Plant Disease 82, 465–469 https://doi.org/10.1094/PDIS.1998.82.5.465
- Sundaram, N. V., Palmer, L. T., Nagarajan, K. & Prescott, J. M. (1972). Disease survey of sorghum and millets in India. Plant Disease Reporter 56, 740–743
- Yaegashi, H. & Udagawa, S. (1978). The taxonomical identity of the perfect state of Pyricularia grisea and its allies. Can. J. Bot. 56, 180–183 https://doi.org/10.1139/b78-023
- Chiapello, H. et al. (2015). Deciphering Genome Content and Evolutionary Relationships of Isolates from the Fungus Magnaporthe oryzae Attacking Different Host Plants. Genome Biol Evol 7, 2896–2912 https://doi.org/10.1093/gbe/evv187
- Douhan, G. W., de la Cerda, K. A., Huryn, K. L., Greer, C. A. & Wong, F. P. (2010). Contrasting Genetic Structure Between Magnaporthe grisea Populations Associated with the Golf Course Turfgrasses Lolium perenne (Perennial Ryegrass) and Pennisetum clandestinum (Kikuyugrass). Phytopathology 101, 85–91 https://doi.org/10.1094/PHYTO-08-10-0205
- Saleh, D., Milazzo, J., Adreit, H., Fournier, E. & Tharreau, D. (2014). South-East Asia is the center of origin, diversity and dispersion of the rice blast fungus, Magnaporthe oryzae. New Phytologist 201, 1440–1456 https://doi.org/10.1111/nph.12627
- Kumar, J., Nelson, R. J. & Zeigler, R. S. (1999). Population structure and dynamics of Magnaporthe grisea in the Indian Himalayas. Genetics 152, 971–984
- Saleh, D. et al. (2012). Sex at the origin: an Asian population of the rice blast fungus Magnaporthe oryzae reproduces sexually. Mol. Ecol. 21, 1330–1344 https://doi.org/10.1111/j.1365-294X.2012.05469.x
- Pagliaccia, D. et al. (2018). Genetic Structure of the Rice Blast Pathogen (Magnaporthe oryzae) over a Decade in North Central California Rice Fields. Microb Ecol 75, 310–317 https://doi.org/10.1007/s00248-017-1029-4
- Viji, G., Wu, B., Kang, S., Uddin, W. & Huff, D. R. (2001). Pyricularia grisea Causing Gray Leaf Spot of Perennial Ryegrass Turf: Population Structure and Host Specificity. Plant Disease 85, 817–826 https://doi.org/10.1094/PDIS.2001.85.8.817
- Farman, M. L. (2002). Pyricularia grisea Isolates Causing Gray Leaf Spot on Perennial Ryegrass (Lolium perenne) in the United States: Relationship to P. grisea Isolates from Other Host Plants. Phytopathology 92, 245–254 https://doi.org/10.1094/PHYTO.2002.92.3.245
- Viji, G. & Uddin, W. (2002). Distribution of Mating Type Alleles and Fertility Status of Magnaporthe grisea Causing Gray Leaf Spot of Perennial Ryegrass and St. Augustinegrass Turf. Plant Disease 86, 827–832 https://doi.org/10.1094/PDIS.2002.86.8.827
- Tredway, L. P., Stevenson, K. L. & Burpee, L. L. (2003). Mating Type Distribution and Fertility Status in Magnaporthe grisea Populations from Turfgrasses in Georgia. Plant Disease 87, 435–441 https://doi.org/10.1094/PDIS.2003.87.4.435
- Tosa, Y., Uddin, W., Viji, G., Kang, S. & Mayama, S. (2007). Comparative Genetic Analysis of Magnaporthe oryzae Isolates Causing Gray Leaf Spot of Perennial Ryegrass Turf in the United States and Japan. Plant Disease 91, 517–524 https://doi.org/10.1094/PDIS-91-5-0517
- Tanaka, A., Tamba, H., Tosa, Y., Mayama, S. & Tani, T. (2000). Gray leaf spot occurred on perennial ryegrass (Lolium perenne) in golf courses. J. Jpn. Soc. Turf. Sci. 29, 38–39
- Tanaka, A., Urashima, A., Tosa, Y., Mayama, S. & Tani, T. (1998). Gray leaf spot occurred on perennial ryegrass. J. Jpn. Soc. Turf. Sci. 27, 116–117
- Kato, H., Yamaguchi, T. (National I. of A. S. & Nishihara, N. (1977). Seed transmission, pathogenicity and control of ragi blast fungus and susceptibility of ragi to Pyricularia spp. from grasses, cereals and Mioga [ginger]. Annals of the Phytopathological Society of Japan (Japan)
- Mueller, K. E. (1972). Gray Leaf Spot of St Augustine Grass. California Turgrass Culture 22, 19–20
- Malca, I. & Owen, J. H. (1957). The gray leaf spot disease of St. Augustinegrass. Plant Disease Report 41, 871–875
- Wong, F. P. (2006). Gray Leaf Spot in the West. Golf Course Management, Mois de Mai
- Uddin, W., Soika, M. D., Moorman, F. E. & Viji, G. (1999). A Serious Outbreak of Blast Disease (Gray Leaf Spot) of Perennial Ryegrass in Golf Course Fairways in Pennsylvania. Plant Disease 83, 783–783 https://doi.org/10.1094/PDIS.1999.83.8.783B
- Uddin, W., Viji, G. & Vincelli, P. (2003). Gray Leaf Spot (Blast) of Perennial Ryegrass Turf : An Emerging Problem for the Turfgrass Industry. Plant Disease 87, 880–889 https://doi.org/10.1094/PDIS.2003.87.8.880
- Carver, R. B., Rush, M. & Lindberg, G. D. (1972). An epiphytotic of ryegrass blast in Louisiana. Plant Disease Report 56, 157–159
- Trevathan, L. E., Moss, M. A. & Blasingame, D. (1994). Ryegrass Blast. Plant Disease 78, 113–118 https://doi.org/10.1094/PD-78-0113
- Landschoot, P. J. & Hoyland, B. F. (1992). Gray leaf spot of perennial ryegrass turf in Pennsylvania. Plant Disease 76, 1280–1282
- Pedersen, D. K., Kane, R. T. & Wilkinson, H. T. (2000). First Report of Gray Leaf Spot Caused by Pyricularia grisea on Lolium perenne in Illinois. Plant Disease 84, 1151–1151 https://doi.org/10.1094/PDIS.2000.84.10.1151B
- Harmon, P., Rane, K., Ruhl, G. & Latin, R. (2000). First Report of Gray Leaf Spot on Perennial Ryegrass in Indiana. Plant Disease 84, 492–492 https://doi.org/10.1094/PDIS.2000.84.4.492B
- Vincelli, P. & Dixon, E. (2002). Resistance to QoI (Strobilurin-like) Fungicides in Isolates of Pyricularia grisea from Perennial Ryegrass. Plant Disease 86, 235–240 https://doi.org/10.1094/PDIS.2002.86.3.235
- Schumann, G. L. & Jackson, N. (1999). First Report of Gray Leaf Spot (Pyricularia grisea) on Perennial Ryegrass (Lolium perenne) in New England. Plant Disease 83, 1073–1073 https://doi.org/10.1094/PDIS.1999.83.11.1073B
- Uddin, W., Viji, G. & Stowell, L. (2002). First Report of Gray Leaf Spot on Perennial Ryegrass Turf in California. Plant Disease 86, 75–75 https://doi.org/10.1094/PDIS.2002.86.1.75C
- Wong, P. F. & de la Cerda, A. K. (2006). First Report of Pyricularia grisea (Gray Leaf Spot) on Perennial Ryegrass ( Lolium perenne ) in Nevada. 90, https://doi.org/10.1094/PD-90-0683A
- Fraser, M. L. (1995). Susceptibility of tall fescues to gray leaf spot. Biol. Cultural Tests 12, 130
- Wong, F. P., Gelernter, W. & Stowell, L. (2005). First Report of Pyricularia grisea Causing Gray Leaf Spot on Kikuyugrass (Pennisetum clandestinum) in the United States. Plant Disease 89, 433–433 https://doi.org/10.1094/PD-89-0433C
- Latin, R. & Harmon, P. (2004). Managing gray leaf spot in the Midwest. Golf Course Management Octobre, 89–92
- Greer, C. A., Scardaci, S. C. & Webster, R. K. (1997). First Report of Rice Blast Caused by Pyricularia grisea in California. Plant Disease 81, 1094–1094 https://doi.org/10.1094/PDIS.1997.81.9.1094A
- Agref. (2018). Bulletin d’alerte N°1. Bulletin d’Alerte Réseau d’épidémio-surveillance 9 p.
- Lau, G. W. & Hamer, J. E. (1998). Acropetal: a genetic locus required for conidiophore architecture and pathogenicity in the rice blast fungus. Fungal Genet. Biol. 24, 228–239 https://doi.org/10.1006/fgbi.1998.1053
- Uddin, W., Viji, G., Schumann, G. L. & Boyd, S. H. (2003). Detection of Pyricularia grisea Causing Gray Leaf Spot of Perennial Ryegrass Turf by a Rapid Immuno-Recognition Assay. Plant Disease 87, 772–778 https://doi.org/10.1094/PDIS.2003.87.7.772
- Harmon, P. F., Dunkle, L. D. & Latin, R. (2003). A Rapid PCR-Based Method for the Detection of Magnaporthe oryzae from Infected Perennial Ryegrass. Plant Disease 87, 1072–1076 https://doi.org/10.1094/PDIS.2003.87.9.1072
- Yang, W. et al. (2014). Early diagnosis of blast fungus, Magnaporthe oryzae, in rice plant by using an ultra-sensitive electrically magnetic-controllable electrochemical biosensor. Analytica Chimica Acta 850, 85–91 https://doi.org/10.1016/j.aca.2014.08.040
- Harmon, P. F. & Latin, R. (2005). Winter Survival of the Perennial Ryegrass Pathogen Magnaporthe oryzae in North Central Indiana. Plant Disease 89, 412–418 https://doi.org/10.1094/PD-89-0412
- Howard, R. J. & Valent, B. (1996). Breaking and entering: host penetration by the fungal rice blast pathogen Magnaporthe grisea. Annu. Rev. Microbiol. 50, 491–512 https://doi.org/10.1146/annurev.micro.50.1.491
- Uddin, W., Serlemitsos, K. & Viji, G. (2003). A Temperature and Leaf Wetness Duration-Based Model for Prediction of Gray Leaf Spot of Perennial Ryegrass Turf. Phytopathology 93, 336–343 https://doi.org/10.1094/PHYTO.2003.93.3.336
- Moss, M. A. & Trevathan, L. E. (1987). Environmental conditions conducive to infection of ryegrass by Pyricularia grisea. Phytopathology (USA)
- Li, Y., Uddin, W. & Kaminski, J. E. (2014). Effects of relative humidity on infection, colonization and conidiation of Magnaporthe orzyae on perennial ryegrass. Plant Pathology 63, 590–597 https://doi.org/10.1111/ppa.12127
- Uddin, W., Burpee, L. L. & Stevenson, K. L. (1998). Influence of temperature, and leaf wetness duration on development of gray leaf spot (blast) of tall fescue. Int. Conf. Plant Prot. Tropics 5th. Kuala Lumpur, Malaysia, 136–141
- Hemmi, T. & Imura, J. (1939). On the relation of air humidity to conidial formation in the rice blast fungus, Pyricularia oryzae, and characteristics in the germination of conidia production by the strains showing different pathogenicity. Annals of the Phytopathological Society of Japan 9, 147–56
- Carisse, O. (1992). Influence of Interrupted Wet Periods, Relative Humidity, and Temperature on Infection of Carrots by Cercospora carotae. 82, https://doi.org/10.1094/Phyto-82-602
- Sutton, J. C., Gillespie, T. J. & Hildebrand, P. D. (1984). Monitoring Weather Factors in Relation to Plant Disease. Plant Disease 68, 68–78 https://doi.org/10.1094/PD-68-78
- Gazon Sport Pro H24. (2018). Comment prévenir la pyriculariose. Gazon Sport Pro H24 article web, http://www.gsph24.com/articles/pyriculariose-gazon-champignon-pr%C3%A9venir
- Escalona, V. H., Aguayo, E., Martínez-Hernández, G. B. & Artés, F. (2010). UV-C doses to reduce pathogen and spoilage bacterial growth in vitro and in baby spinach. Postharvest Biology and Technology 56, 223–231 https://doi.org/10.1016/j.postharvbio.2010.01.008
- Janisiewicz, W. J., Takeda, F., Glenn, D. M., Camp, M. J. & Jurick, W. M. (2015). Dark Period Following UV-C Treatment Enhances Killing of Botrytis cinerea Conidia and Controls Gray Mold of Strawberries. Phytopathology 106, 386–394 https://doi.org/10.1094/PHYTO-09-15-0240-R
- Nigro, F., Ippolito, A. & Lima, G. (1998). Use of UV-C light to reduce Botrytis storage rot of table grapes. Postharvest Biology and Technology 13, 171–181 https://doi.org/10.1016/S0925-5214(98)00009-X
- Pombo, M. A., Rosli, H. G., Martínez, G. A. & Civello, P. M. (2011). UV-C treatment affects the expression and activity of defense genes in strawberry fruit (Fragaria×ananassa, Duch.). Postharvest Biology and Technology 59, 94–102 https://doi.org/10.1016/j.postharvbio.2010.08.003
- Stevens, C. et al. (1999). Induced resistance of sweetpotato to Fusarium root rot by UV-C hormesis. Crop Protection 18, 463–470 https://doi.org/10.1016/S0261-2194(99)00045-9
- Yin, X. et al. (2016). Insights into the Mechanisms Underlying Ultraviolet-C Induced Resveratrol Metabolism in Grapevine (V. amurensis Rupr.) cv. “Tonghua-3”. Front Plant Sci 7, https://doi.org/10.3389/fpls.2016.00503
- Suthaparan, A. et al. (2016). Suppression of Powdery Mildews by UV-B: Application Frequency and Timing, Dose, Reflectance, and Automation. Plant Disease 100, 1643–1650 https://doi.org/10.1094/PDIS-12-15-1440-RE
- Vaiciunas, S. & Clarke, B. B. (2000). Impact of cultural practices and genotype on the development of gray leaf spot in cool season turfgrasses. Proceedings Rutgers Turfgrass Sympos. New Brunswick, NJ.,
- Williams, D. W., Burrus, P. B. & Vincelli, P. (2001). Severity of Gray Leaf Spot in Perennial Ryegrass as Influenced by Mowing Height and Nitrogen Level. Crop Science 41, 1207–1211 https://doi.org/10.2135/cropsci2001.4141207x
- Clarke, B. B. & Vaiciunas, S. (2001). Best management practices for control of gray leaf spot. Phytopathology 91, 148
- Uddin, W., Soika, M. D., Shelton, J. & Soika, E. L. (2001). Severity of gray leaf spot (blast) of perennial ryegrass turf as influenced by nitrogen source. Phytopathology 91, S90
- Clarke, B. B. (2007). Managing Gray Leaf Spot on Perennial Ryegrass. Présentation Powerpoint Rutgers University, https://turf.rutgers.edu/research/sierraturfconfgls.pdf
- Nanayakkara, U. N., Uddin, W. & Datnoff, L. E. (2009). Soil silicon amendment for managing gray leaf spot of perennial ryegrass turf on golf courses in Pennsylvania. Canadian Journal of Plant Pathology 31, 415–426 https://doi.org/10.1080/07060660909507616
- Romero, A., Munévar, F. & Cayón, G. (2011). Silicon and plant diseases. A review. Agronomía Colombiana 29, 473–480
- Datnoff, L. E., Deren, C. W. & Snyder, G. H. (1997). Silicon fertilization for disease management of rice in Florida. Crop Protection 16, 525–531 https://doi.org/10.1016/S0261-2194(97)00033-1
- Fauteux, F., Rémus-Borel, W., Menzies, J. G. & Bélanger, R. R. (2005). Silicon and plant disease resistance against pathogenic fungi. FEMS Microbiol. Lett. 249, 1–6 https://doi.org/10.1016/j.femsle.2005.06.034
- Rahman, A., Wallis, C. M. & Uddin, W. (2015). Silicon-Induced Systemic Defense Responses in Perennial Ryegrass Against Infection by Magnaporthe oryzae. Phytopathology 105, 748–757 https://doi.org/10.1094/PHYTO-12-14-0378-R
- Brecht, M. O., Datnoff, L. E., Kucharek, T. A. & Nagata, R. T. (2004). Influence of Silicon and Chlorothalonil on the Suppression of Gray Leaf Spot and Increase Plant Growth in St. Augustinegrass. Plant Disease 88, 338–344 https://doi.org/10.1094/PDIS.2004.88.4.338
- Dammie, N. (2017). Biological control of gray leaf spot (Pyricularia grisea (cooke) sacc.) of ryegrass.
- Curley, J. et al. (2005). QTL mapping of resistance to gray leaf spot in ryegrass. Theor. Appl. Genet. 111, 1107–1117 https://doi.org/10.1007/s00122-005-0036-x
- Bonos, S. A., Kubik, C., Clarke, B. B. & Meyer, W. A. (2004). Breeding Perennial Ryegrass for Resistance to Gray Leaf Spot. Crop Science 44, 575–580 https://doi.org/10.2135/cropsci2004.5750
- Hamblin, A. & Hofmann, N. E. (Universite I. (2001). Breeding for gray leaf spot resistance. Phytopathology 91, S148
- Curley, J., Chakraborty, N., Chang, S. & Jung, G. (2008). QTL Mapping of Resistance to Gray Leaf Spot in Ryegrass: Consistency of QTL between Two Mapping Populations. Asian Journal of Turfgrass Science 22, 85–100
- Curley, J. & Geunhwa, J. (2005). Quantitative trait Loci (QTL) mapping of resistance to gray leaf spot in Lolium. USGA’s Tuifgrass and Environmental Research Online http://archive.lib.msu.edu/tic/ressum/2005/26.pdf
- Jo, Y.-K., Wang, G.-L. & Boehm, M. J. (2007). Expression Analysis of Rice Defense-Related Genes in Turfgrass in Response to Magnaporthe grisea. Phytopathology 97, 170–178 https://doi.org/10.1094/PHYTO-97-2-0170
- Reicher, Z. J. & Hardebeck, G. A. (2002). Overseeding Strategies for Converting Golf Course Fairways to Creeping Bentgrass. HortScience 37, 508–510
- Kraft, R. W., Keeley, S. J. & Su, K. (2004). Conversion of Fairway-Height Perennial Ryegrass Turf to Kentucky Bluegrass without Nonselective Herbicides. Agronomy Journal 96, 576–579 https://doi.org/10.2134/agronj2004.5760
- Vincelli, P. & Farman, M. L. (2007). Update of fungicide resistance in Gray Leaf Spot. Golf Course Management
- Vincelli, P. & Dixon, E. (2002). Update: Fungicide failure against gray leaf spot. Golf Course Management Janvier, 53–55
- Dernoeden, P. H. (2001). Gray leaf spot control with fungicides. Fungi. Nematicide Tests 56, T32
- Dernoeden, P. H., Krouse, J. M. & Kaminski, J. E. (2001). Gray leaf spot control with fungicides. Fungi. Nematicide Tests 56, T31
- Towers, G. W. et al. (1999). Efficacy of fungicides for control of gray leaf spot on perennial ryegrass. Fungi. Nematicide Tests 55, 520–521
- Uddin, W., Soika, M. D. & Soika. (2005). Evaluation of Fungicides for Control of Gray Leaf Spot on Perennial Ryegrass. Penn State University Report 2 p.
- Vincelli, P., Dixon, E. & Williams, D. W. (2000). Efficacy of fungicides for control of gray leaf spot of perennial ryegrass. Nematicide Tests 56, T38
- Vincelli, P. & Williams, D. W. (1998). Efficacy of fungicides for control of gray leaf spot of perennial ryegrass. Fungi. Nematicide Tests 54, 524–525
- Vincelli, P., Dixon, E. & Williams, D. (1999). Efficacy of fungicides for control of gray leaf spot of perennial ryegrass. Nematicide Tests 55, 529
- Vincelli, P., Dixon, E. & Williams, D. (2002). Efficacy of fungicides for control of gray leaf spot of perennial ryegrass. Fungi. Nematicide Tests 57, T33
- Vincelli, P. (2000). Fungicide control of gray leaf spot. Golf Course Management Juin, 68–74
- Vincelli, P., Dixon, E. & Williams, D. (2000). Timing of fungicides for control of gray leaf spot of perennial ryegrass. Nematicide Tests 55, 531
- Vincelli, P. & Williams, D. (1999). Timing of Heritage 50WG fungicide for control of gray leaf spot of perennial ryegrass. Nematicide Tests 54, 526
- Kim, Y.-S., Dixon, E. W., Vincelli, P. & Farman, M. L. (2003). Field Resistance to Strobilurin (QoI) Fungicides in Pyricularia grisea Caused by Mutations in the Mitochondrial Cytochrome b Gene. Phytopathology 93, 891–900 https://doi.org/10.1094/PHYTO.2003.93.7.891
- Ma, B. & Uddin, W. (2009). Fitness and Competitive Ability of an Azoxystrobin-Resistant G143A Mutant of Magnaporthe oryzae from Perennial Ryegrass. Plant Disease 93, 1044–1049 https://doi.org/10.1094/PDIS-93-10-1044
- Vincelli, P. & Dixon, E. (2002). Evaluation of spray programs for controlling QoI resistant strains of Pyricularia Grisea on perennial ryegrass. Fungi. Nematicide Tests 57, T37
- Vincelli, P. & Munshaw, G. (2017). Chemical Control of Turfgrass Disease 2017. UKnowledge University of Kentucky, 1–32
- Sitther, V., Uddin, W. & Romaine, C. (2003). Suppression of gray leaf spot (blast) of perennial ryegrass turf by Pseudomonas aeruginosa from spent mushroom substrate. 26, https://doi.org/10.1016/S1049-9644(02)00170-6
- Viji, G. & Uddin, W. (2001). Biocontrol of gray leaf spot (blast) of perennial ryegrass by Bacillus lentimorbus. Phytopathology 91, S92
- McDonald, S. J., Dernoeden, P. H. & Bigelow, C. A. (2006). Dollar Spot and Gray Leaf Spot Severity as Influenced by Irrigation, Chlorothalonil, Paclobutrazol, and a Wetting Agent. Crop Science 46, 2675–2684 (2006).https://doi.org/10.2135/cropsci2005.12.0495
- Farman et al. (2017). Pyricularia grisea Isolates Causing Gray Leaf Spot on Perennial Ryegrass (Lolium perenne) in the United States: Relationship to P. grisea Isolates from Other Host Plants. Plant Disease 101, 684–692. https://apsjournals.apsnet.org/doi/10.1094/PDIS-05-16-0700-RE
- J. Milazzo, A. Pordel, S. Ravel, and D. Tharreau (2019). First Scientific Report of Pyricularia oryzae Causing Gray Leaf Spot Disease on Perennial Ryegrass (Lolium perenne) in France. Plant Disease 103, 1024. https://doi.org/10.1094/PDIS-09-18-1545-PDN
- K. Entwistle (2020). Gray leaf spot on perennial ryegrass, Grounds Management Association. https://thegma.org.uk/news/gray-leaf-spot-perennial-ryegrass
- J. Aarrouf et al. (2022). Flashes of UV-C light are perceived by UVR8, the photoreceptor of UV-B light Journal of Plant Science and Phytopathology, http://dx.doi.org/10.29328/journal.jpsp.1001089
- J. Aarrouf, L. Urban (2020). Flashes of UV-C light: An innovative method for stimulating plant defences. Plos One 15, 151-153 https://doi.org/10.1371/journal.pone.0235918
- Y. Li (2013). Factors influencing the development of gray leaft spot of perennial ryegrass turf and seasonal availability of the inoculum. Thèse de doctorat. Université de Pennsylvanie. 237 p. https://etda.libraries.psu.edu/catalog/16380
Galerie de photographies du pathogène